由乳化剂稳定的乳液能将一种液体分散在另外一种与之不相溶的液体中,可应用在食品、医药、化妆品、个人护理和石油工业等领域 [1]。近年来,由胶体粒子稳定的Pickering乳液因没有表面活性剂和具有较高的稳定性,引起了极大的关注[2]。在分子间力、氢键、静电和疏水等弱相互作用下,双亲性聚合物可自组装成胶体粒子。这种胶体粒子,可应用于催化、生物材料、生物医药、光电材料等不同的领域[3]。自组装胶体粒子具有表面活性和可控的结构,可自组装在油水界面稳定Pickering乳液。Fujii[4]首次报道了由聚环氧乙烷-b-聚甲基丙烯酸单甘油酯-b-聚二甲胺乙基甲基丙烯酸酯(PEO-b-PGMA-b-PDEA)三嵌段聚合物自组装的壳交联胶体粒子,作为pH值响应型颗粒乳化剂能稳定水包油(O/W)乳液。Liu课题组也研究了基于双亲性聚合物自组装胶体粒子的表面活性和作为颗粒乳化剂稳定Pickering的应用[5~9]。但是,这些胶体粒子多数起源于合成的聚合物,限制了其在食品、化妆品和医药领域的应用。因此,人们致力于发展环境友好型和生物基颗粒乳化剂稳定Pickering乳液,例如甲壳素纳米晶[10]、改性淀粉[11]、蛋白质纳米粒子[2]和铁蛋白[12]等。
海藻酸盐是一种线性阴离子多糖,是由α-L-古罗糖醛酸和β-D-甘露糖醛酸残基共价键合形成的共聚物[13]。海藻酸盐具有生物降解性、生物相容性以及无免疫原性和无毒性,是一种公认的安全物质[14]。作为一种天然的生物聚合物,在食品和制药行业中有极大的应用潜力[15]。溶菌酶可降解细菌细胞壁,具有热稳定性和杀菌活性;同时,溶菌酶等电点较高(pI=11)在较宽的pH值范围内带正电,与聚合物的相互作用较强[16]。Takahashi[17]研究了海藻酸和溶菌酶复合物中溶菌酶的活性以及pH值、底物浓度、温度等各种因素对溶菌酶活性的影响。但是,这项研究仅限于复合物,没有涉及海藻酸和溶菌酶自组装胶体粒子。2016年,Fuenzalida[18]等研究了海藻酸和溶菌酶静电自组装复合胶体粒子的理化性质和潜在的应用,详细研究了海藻酸的M/G比(甘露糖醛酸/古洛糖醛酸)、重均分子量、Ca2+的添加量对海藻酸和溶菌酶复合能力及复合胶体粒子性质的影响。结果表明,复合后的溶菌酶活性低于自由酶。这项研究,在一定条件下给出了海藻酸和溶菌酶自组装胶体粒子的性质及潜在应用。本文研究海藻酸钠(ALG)和溶菌酶(Lys)的自组装过程并表征自组装胶体粒子(Lys/ALG);将制备的胶体粒子二次组装在油水界面稳定Pickering乳液,进一步研究盐浓度和pH值对自组装胶体粒子性质及乳液性能的影响以及乳液中溶菌酶的活性。
1 实验方法
1.1 实验用原料和试剂
海藻酸钠(ALG):分析级;溶菌酶(Lys):分析级;溶壁微球菌:医药级;白油(26#):食品级;氢氧化钠、氯化钠和盐酸:分析级。
1.2 Lys/ALG胶体粒子的制备和表征
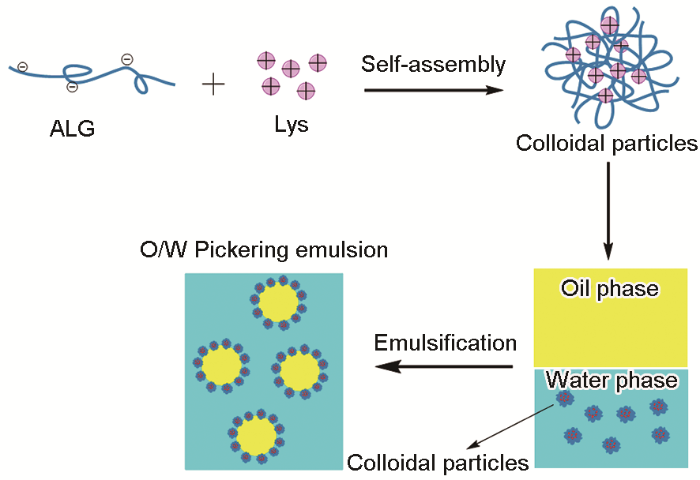
图1给出了Lys/ALG胶体粒子的制备及油水界面二次组装示意图。为了制备胶体粒子Lys/ALG,先制备3 mL浓度为1 mg/mL的ALG水溶液:将等体积不同浓度的Lys水溶液逐滴加入ALG水溶液中,使Lys与ALG的质量比(WR Lys/ALG)分别为2∶1,3∶1,3.5∶1,3.75∶1,4∶1,4.25∶1和4.5∶1,形成Lys/ALG胶体粒子。ALG带负电,Lys在较宽的pH范围内带正电,Lys水溶液滴到ALG溶液的过程中,二者之间通过静电相互作用生成胶体粒子。
图1
图1
Lys/ALG胶体粒子的制备及油水界面二次组装示意图
Fig.1
Preparation of Lys/ALG colloidal particles and schematic diagram of secondary assembly at the oil-water interface
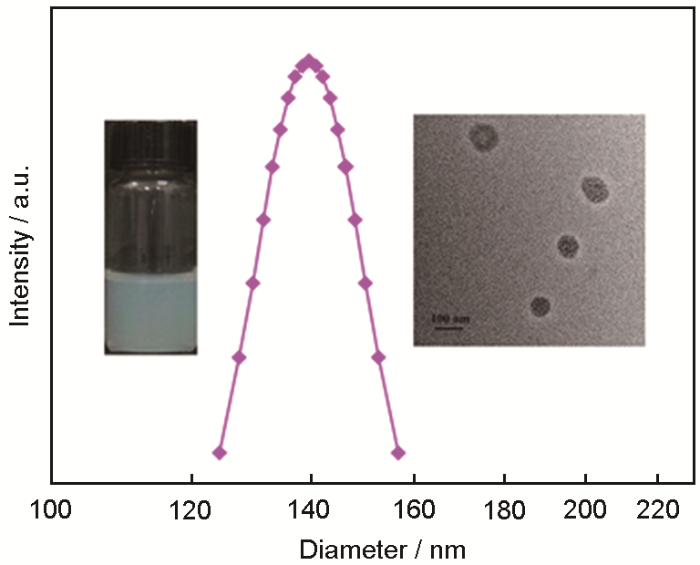
用Zetasizer Nano ZS90型Zeta电位仪,在室温和90°散射角下测量不同条件下胶体粒子的粒径和电位。用JEM-2100透射电镜(TEM)观察WR 3.75∶1的复合胶体粒子的形貌,操作电压为200 kV。
1.3 乳液的制备和表征
以WR为3.75∶1的胶体粒子水溶液(0.625 mg/mL)作为水相,白油为油相,其体积比为1∶1,在室温下用XHF-D型高速分散器以8000 r/min的转速下将其均质2 min。将一滴乳液滴在水中,乳液滴很快分散从而确定乳液为水包油型。用数码相机拍摄乳液静置的表观状态。用DMBA450型光学显微镜观测乳液滴形态和大小,用显微镜自带软件统计乳液滴平均粒径及分散度。
1.4 溶菌酶活性的测定
测量乳液中溶菌酶的活性的步骤为:将预先制备好的乳液在4℃和8000 r/min的转速离心20 min,破乳后分离水相;水相中溶菌酶的活性即为乳液的酶活。参考文献[19]中的方法测定水相中溶菌酶活性。主要步骤:用冻干的溶壁微球菌作为底物,用pH值为6.2、0.1 mol/L的磷酸盐缓冲液配制不同浓度的溶菌酶溶液,0.3 mL将待测液与2.5 mL底物混合。用UV-2700紫外可见分光光度计测量吸光度,使混合液在540 nm处的吸光度约为0.8。然后在540 nm处每隔30 s测其吸光度的降低值,共持续5 min。根据酶活性定义(28℃,pH值为6.2条件下每克组织每分钟使OD 540下降0.001时所需的酶量为1个活力单位)计算酶活。
2 结果和讨论
2.1 胶体粒子的生成机制和形貌
制备胶体粒子时,将ALG溶解在纯水中然后逐滴加入Lys水溶液。ALG带负电而Lys在较宽的pH范围内带正电,在Lys水溶液滴到ALG溶液的过程中二者之间通过静电相互作用生成胶体粒子。其大致组装过程为:ALG的分子链较长。随着Lys的加入,ALG和Lys在静电作用下生成初级疏水复合物片段并因相互作用而聚集。Lys/ALG链段的柔韧性好,电荷密度较高,在静电作用、范德华力、分子间/内氢键、疏水等的作用下,Lys/ALG链段在溶液中相互交错盘绕[20],最终形成三维交叉的网络结构,即为疏水的核。Lys/ALG链段上未复合的COO-包围在核的外围,形成胶体粒子亲水的外壳以维持胶体粒子稳定性。
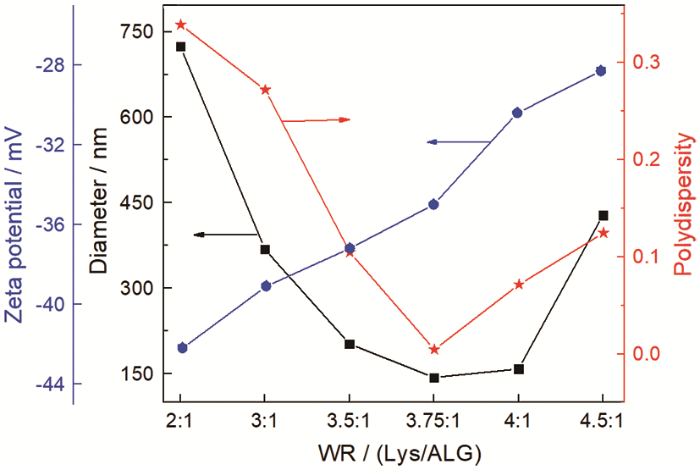
实验中先固定ALG的质量,改变Lys的质量制备出一系列不同Lys/ALG质量比的胶体粒子。胶体粒子的粒径,电位和分散性指数与WR的关系,如图2所示。当Lys/ALG质量比WR低于2:1时,溶菌酶浓度过低使其与ALG的相互作用较弱,不能形成胶体粒子;WR高于4.5∶1时,溶菌酶浓度过高使形成的胶体粒子不稳定,易沉淀;WR在2∶1和4.5∶1之间时,随着溶菌酶浓度的提高ALG和Lys之间的相互作用增强,使胶体粒子的粒径和分散性指数逐渐减小。WR为3.75∶1时生成的胶体粒子最密实,粒径为143 nm,分散性指数为0.005,粒径和分散性指数均最小。随后,随着溶菌酶浓度的继续提高,过量的溶菌酶使胶体粒子粒径和分散性指数增大。同时,随着溶菌酶的加入溶菌酶的正电荷逐渐中和海藻酸钠的负电荷,使胶体粒子的ζ电位逐渐提高。本文后续研究的胶体粒子,其质量比都为3.75∶1。
图2
图2
Lys/ALG胶体粒子的粒径,ζ电位和多分散度与质量比WR的关系
Fig.2
Variation of particle size, ζ-potential and polydispersity of Lys/ALG colloidal particles with mass ratio WR
图3
图3
Lys/ALG胶体粒子的粒径分布、表观照片和TEM图
Fig.3
Particle size distribution, Apparent photo (left inset) and TEM image (right inset) of Lys/ALG colloidal particles, mass ratio WR 3.75∶1, the concentration of colloidal particles is 0.625 mg/mL
2.2 pH值对复合胶体粒子结构和乳液性能的影响
2.2.1 pH值对复合胶体粒子结构的影响
图4
图4
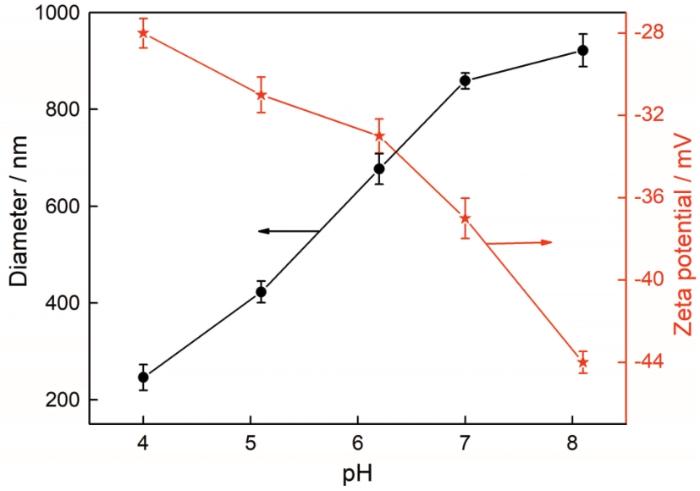
胶体粒子粒径和ζ电位与pH值的关系
Fig.4
Variation of colloidal particle size and ζ-potential with pH, WR 3.75∶1, the concentration of colloidal particles is 0.625 mg/mL
2.2.2 pH值对乳液性能的影响
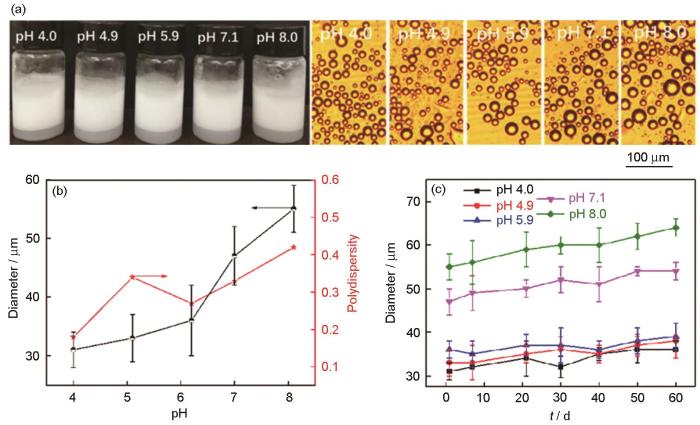
pH值对乳液性能的影响,如图5所示。图5A中的乳化瓶照片显示,不同pH值条件下均能得到稳定的乳液,表明制备出的自组装胶体粒子具有表面活性;显微镜照片表明,随着pH值从4.0增大到8.0,乳液滴的平均粒径逐渐增大。图5B给出了不同pH致乳液滴粒径和分散指数的数值。可以看出,随着pH的增大乳液滴的平均粒径从31 μm增加到55 μm。其原因是,pH的增大使胶体粒子的粒径增大,较大的粒子形成较大的乳液滴,使乳化性能变差[22];同时,由图4可知,pH值的增加使胶体粒子的净荷电量增加,粒子的亲水性增加,乳化性能亦变差。即使如此,不同pH值粒子表面还存在疏水微区而维持了良好的两亲性,因此乳液并没有出现油水分离而破乳。图5B表明,乳液滴的粒径分散指数最小值为0.18,最大值为0.42,呈现出多分散性。不同pH值乳液的长期稳定性,如图5C所示。可以看出,随着静置时间的延长,60 d后pH值为4.0、4.9和5.9的乳液其乳液滴平均粒径基本上不变。pH值为7.1和8.0的乳液,其乳液滴平均粒径稍有增大。其原因是,pH值增大使粒子的溶胀度增加,使其在油水界面的稳定性降低。因此,随着静置时间的延长乳液发生轻微的聚并和奥氏熟化,使乳液滴的粒径稍有增大。但是在整体上,乳液的长期稳定性较高。
图5
图5
不同pH值乳液的数码照片和乳液滴的显微镜照片、乳液滴平均粒径和多分散度与pH值的关系以及乳液滴平均粒径随时间的变化
Fig.5
Digital photographs of emulsions and microscope photographs of emulsion droplets with different pH (a); average particle diameter and polydispersity of emulsion droplets as a function of pH (b); average particle diameter of emulsion droplets as a function of time (c). The emulsions were incubated 1 day after homogenization. WR 3.75∶1, the concentration of colloidal particles is 0.625 mg/mL
2.3 盐浓度对胶体粒子结构和乳液性能的影响
2.3.1 盐浓度对胶体粒子结构的影响
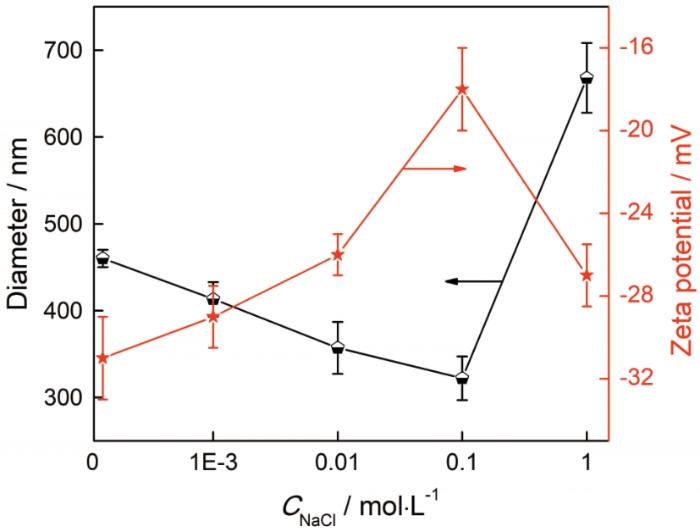
图6给出了盐浓度对胶体粒子结构的影响,选取pH值为5.9。可以看出,随着盐浓度的提高胶体粒子的ζ电位先提高后降低。盐浓度为0.1 mol/L时,ζ电位达到最大。其原因是,加入少量的盐屏蔽了部分电荷,使电位提高。盐浓度达到1 mol/L时,过稿的离子强度减弱了海藻酸和溶菌酶之间的静电作用,使部分胶体粒子解离。解离释放出的海藻酸,使体系的ζ电位降低[23]。同时,随着盐浓度的提高胶体粒子的平均粒径先减小后增大。盐浓度为0.1 mol/L时,平均粒径达到最小值。其原因是,少量的盐使胶体粒子的疏水性增强,粒径减小。当盐浓度进一步提高时,一方面,体系ζ电位减小,荷电量增加,粒子溶胀;另一方面,部分胶体粒子发生解离。以上因素均导致胶体粒子的粒径增大。
图6
图6
胶体粒子粒径和ζ电位与盐浓度的关系
Fig.6
Variation of colloidal particle size and ζ-potential with salt concentration, pH 5.9, WR 3.75∶1, the concentration of colloidal particles is 0.625 mg/mL
2.3.2 盐浓度对乳液性能的影响
不同盐浓度乳液的性能,如图7所示。图7a和b表明,随着盐浓度从0 mol/L提高到0.1 mol/L乳液逐渐变得细腻,乳液滴的平均粒径也逐渐减小,从43 μm减小至20 μm;相应的乳液滴的分散指数也呈现降低趋势。其原因是:一方面,少量的盐使胶体粒子的疏水性增强,粒子在油滴表面吸附的数量增加;另一方面,较小尺寸的粒子能形成较小尺寸的乳液滴[21]。这些结果,与先前报道的结果一致[6]。当盐浓度继续增加到1 mol/L时,乳液滴的平均粒径突然增大到78 μm,分散指数也突增。其原因是,胶体粒子间静电斥力的增大使界面吸附的粒子数目减少,乳液滴的尺寸增大;另外,较大尺寸的粒子也容易形成较大尺寸的乳液滴。图7c给出了乳液的长期稳定性。可以看出,除了盐浓度为1 mol/L的乳液和乳液滴的平均粒径稍有增加外,其他盐浓度的乳液滴平均粒径基本上不随时间变化。其原因是,盐浓度为1 mol/L时形成的胶体粒子较为溶胀,粒子在油水界面的稳定性较差,使乳液滴的粒径轻微增加。
图7
图7
不同盐浓度乳液的数码照片和乳液滴的显微镜照片、乳液滴平均粒径和多分散度与盐浓度的关系以及乳液滴平均粒径随时间的变化
Fig.7
Digital photographs of emulsions and microscope photographs of emulsion droplets with different salt concentrations (a); average particle diameter and polydispersity of emulsion droplets as a function of salt concentration (b); average particle diameter of emulsion droplets as a function of time (c). The emulsions were incubated 1 day after homogenization. pH 5.9, WR 3.75∶1, the concentration of colloidal particles is 0.625 mg·mL-1
2.4 胶体粒子的乳化能力
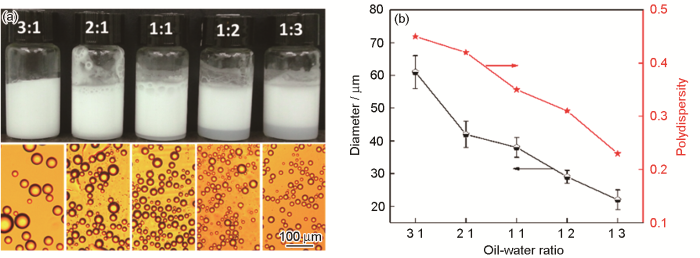
选取不同的油水比,考察胶体粒子的乳化能力。油相和水相的总体积保持不变,增大油相的体积得到油水比分别为1∶3,1∶2,1∶1,2∶1和3∶1的乳液,结果如图8所示。从乳液的数码照片(图8a)可见,随着油水体积比从1∶3增加到3∶1,乳液层的高度逐渐增大;但是,乳液滴显微镜照片显示,乳液滴的平均粒径逐渐增大。图8b给出了具体数值。当油水体积比从1∶3增加到3:1时乳液滴的平均粒径从22 μm增大到61 μm;相应的分散指数从0.23增加到0.45,基本上为多分散分布0。其原因是,油水比增大使油相的体积增加而水相的体积降低,使能稳定油相的胶体粒子的数目减少[22]。因此,平均乳液滴的平均粒径增加。当油水比大于3∶1时,很快出现油水分离,因为没有足够的粒子稳定乳液。
图8
图8
不同油水比胶体粒子的乳化性能:乳液的数码照片和乳液滴的显微镜照片以及乳液滴的平均尺寸和多分散度
Fig.8
Emulsification properties of colloidal particles with different oil-water ratios. (a) digital photo of emulsion and microscope photo of emulsion droplets; (b) average size and polydispersity of emulsion droplets. The emulsion was prepared for 5 hours. pH 5.9, WR 3.75∶1, the concentration of colloidal particles is 0.625 mg/L
2.5 乳液中溶菌酶的活性
自由溶菌酶和组装为胶体粒子后溶菌酶的活性,如图9所示。自由溶菌酶的活性为713 U m/L,与ALG复合后形成的胶体粒子中溶菌酶的活性为635 U m/L,表明活性有所降低。但是降低幅度不大,保留了纯溶菌酶约89%的活性。其原因是,复合后溶菌酶的构象发生了轻微的变化。胶体粒子和油相均质乳化后,溶菌酶的活性进一步下降到411 U m/L,为纯溶菌酶活性的58%。其原因是,均质过程进一步使溶菌酶活性的部分损失。但是,乳液中溶菌酶仍保留了纯溶菌酶的大部分活性。
图9
图9
自由溶菌酶,Lys/ALG胶体粒子和胶体粒子制备的乳液的溶菌酶的活性
Fig.9
Activity of native Lys, Lys/HA colloidal particles and the corresponding emulsions. The emulsions were incubated 1 day after homogenization. The concentration of Lys is 0.625 mg m/L
图10
图10
不同pH乳液中溶菌酶的活性和不同盐浓度乳 液中溶菌酶的活性,pH 值为5.9
Fig.10
Activity of Lys in emulsions with different pH (a); activity of Lys in emulsions with different salt concentrations, pH 5.9 (b). The emulsions were incubated 1 day after homogenization. The concentration of Lys is 0.625 mg/mL
3 结论
用海藻酸和溶菌酶可静电自组装球形结构的胶体粒子。胶体粒子具有表面活性,可二次组装在油水界面稳定水包油Pickering乳液。随着pH值的增大,胶体粒子粒径和乳液滴平均粒径随之增大。在盐浓度为0.1 mol L-1时胶体粒子的ζ电位最大,胶体粒子的粒径和乳液滴平均粒径最小。乳液中溶菌酶活性保留了纯溶菌酶活性的58%。不同pH值和盐浓度的乳液,均保留了部分溶菌酶活性。
参考文献
Stabilization of water-in-oil emulsions with continuous phase crystals
[J].
Characterization of Pickering emulsion gels stabilized by zein/gum arabic complex colloidal nanoparticles
[J].
Syntheses of shell cross-linked micelles using acidic ABC triblock copolymers and their application as pH-responsive particulate emulsifiers
[J].
Self-Assembly and emulsification of poly{[styrene-alt-maleic acid]-co- [styrene-alt-(N-3,4-dihydroxyphenylethylmaleamic acid)]}
[J].
Pickering emulsions stabilized by self-assembled colloidal particles of copolymers of P(St-alt-MAn)-co-P(VM-alt-MAn)
[J]. J.
Influence of photo-cross-linking on emulsifying performance of the self-assemblies of poly(7-(4-vinylbenzyloxyl)-4-methylcoumarin-co-acrylic acid
[J].
Self-assembly and emulsification behavior of photo-sensitive p(St/CS-alt-MA) copolymer
[J].
探索光敏性共聚物P(St/CS-alt-MA)的自组装及其乳化行为
[J].
Structure and emulsification performance of amphiphilic copolymer self-Assembled micelles
[J].
双亲性无规共聚物自组装胶束结构及其乳化性能
[J].
Oil-in-water emulsions stabilized by chitin nanocrystal particles
[J].
Preparation and characterizations of Pickering emulsions stabilized by hydrophobic starch particles
[J].
Ferritin as a bionano-particulate emulsifier
[J]. J.
Biopolymer nanoparticle production for controlled release of biopharmaceuticals
[J].
Alginic acid nanoparticles prepared through counterion complexation method as a drug delivery system
[J].
Hydrogels for tissue engineering, scaffold design variables and applications
[J].
Production of human lysozyme in biofilm reactor and optimization of growth parameters of Kluyveromyces lactis K7
[J].
Activities of lysozyme complexed with polysaccharides and potassium poly (vinyl alcohol sulfate) with various degrees of esterification
[J].
On the role of alginate structure in complexing with lysozyme and application for enzyme delivery
[J].
A rapid and sensitive assay of muramidase
[J].
Formation and properties of positively charged colloids based on polyelectrolyte complexes of biopolymers
[J].
Self-assembled papain/HA-Phe composite nanoparticles and emulsification properties
[J].
Papain/HA-Phe自组装复合纳米粒子及乳化性能
[J].
Simple, reversible emulsion system switched by pH on the basis of chitosan without any hydrophobic modification
[J].
Controlled release of doxorubicin from doxorubicin/γ-polyglutamic acid ionic complex
[J]. J.
Influence of pH on the activity of chymotrypsin at a solid-liquid interface
[J].
Effect of salts and other factors on lysozyme activity
[J].