Queiroz等[15]以莓种子为原料在不同温度将其炭化并使用氢氧化钾将其活化制备改性活性炭,发现莓种子活性炭对Pt2+的吸附率为86%、对Fe2+的吸附率为69%。Fita等[16]将楝树在600℃热解研究其吸附Cu2+的性能和机理,发现楝树活性炭对Cu2+的最大吸附容量为74.23 mg/g。Vunain等[17]用NaOH将稻壳和马铃薯皮活化,然后再将其炭化制备出生物质活性炭。这种生物质活性炭在180 min对200 mg/L的铬离子的吸附效率分别为71.72%和62.28%。Dao等[18]用H3PO4将果壳改性并在500℃进行炭化处理,发现其对Cu2+和Zn2+的吸附性能分别为95.92%和67.41%。
1 实验方法
1.1 实验用试剂和仪器设备
实验用试剂:芦荟青皮(AL);去离子水;七水合硫酸亚铁(FeSO4.7H2O);六水合硝酸镍(Ni(NO3)2·6H2O);六水合硝酸钴(Co(NO3)2·6H2O);六水合硝酸锌(Zn(NO3)2·6H2O);浓盐酸(HCl)以及氢氧化钠(NaOH)。
实验用仪器设备:DHG-9036A型电热恒温鼓风干燥箱;pH计;GSL-1600X型高温真空管式炉;100T型高速多功能粉碎机;SHZ-82A型气浴恒温振荡器;PPMS DynaCool型综合物性系统;3H-2000PS1型自动氮气吸附仪;Nanosem430型扫描电子显微镜;Nicolet is 50型傅立叶红外光谱仪;Zetasizer Nano ZS90型Zeta电位仪;ESCALAB25型X-射线光电子能谱仪;ICPS-7510 PLUS型电感耦合等离子体原子发射光谱仪。
1.2 FeSO4 掺杂磁性芦荟青皮生物炭的制备
将洗净晒干的芦荟青皮放在105℃鼓风干燥箱中干燥24 h,然后用粉碎机将其打碎成粉末并过80目筛,将得到芦荟青皮粉末密封。
将三份FeSO4置于烧杯中,分别加入适量纯水配置FeSO4溶液;按照AL与FeSO4 1∶1,2∶1,3∶1的质量比称取三份AL粉末并将其与FeSO4溶液混合均匀后放入高压反应釜内。将高压反应釜放在温度为200℃的鼓风干燥箱中干燥16 h,得到磁性芦荟青皮生物炭前驱体。将这种前驱体置于高温真空管式炉中,在氮气(60 mL/min)气氛中以5℃/min的速率升温至800℃,热解3 h后冷却至室温。将得到的产物研磨至大约80目,过筛后得到FeSO4掺杂磁性芦荟青皮生物炭,将其记为FSBC x-y,其中x-y为AL与FeSO4的质量比。
1.3 性能表征
1.3.1 吸附等温线的测定
式中C0 (mg·L-1)为金属离子的初始浓度,Ct (mg·L-1)为t时刻金属离子的浓度,V(L)为金属离子溶液的体积,m(g)为吸附剂的质量。
用Langmuir吸附等温线模型分析实验数据,Langmuir等温线的数学表达式为[25,26]
式中qe (mg·g-1)为平衡吸附量,qm (mg·g-1)为理论最大吸附量,Ce (mg·L-1)为金属离子在平衡时的浓度,KL (L·mg-1)为表面吸附亲和性。
1.3.2 吸附动力学的测定
在8份体积为50 mL、浓度为300 mg·L-1的金属离子溶液中分别加入50 mg的FSBC x-y,然后将其放入恒温振荡摇床(120 r/min,25℃)中。分别在时间点为10,30,60,120,240,480,960和1440 min时取出样品,用ICP测出溶液中剩余吸附质的浓度。使用拟二级动力学扩散模型分析磁性芦荟青皮生物炭吸附金属离子的吸附过程,拟二级动力学模型的表达式为[27,28]
式中t (min)为吸附时间;qt (mg·g-1)为t时刻的吸附量。qe (mg·g-1)为平衡时的吸附量,K2 (g·(mg·min-1)-1)为拟二级动力学常数。
1.3.3 固定床吸附
在室温25℃测试FSBC3-1在流速为1 mL·min-1的固定床吸附过程。在长10 cm、内径为0.8 cm的玻璃圆管中加入200 mg吸附剂模拟吸附柱,使用棉花管塞防止吸附剂被水流带走,蠕动泵将初始浓度为50 mg·L-1的吸附质溶液泵入吸附柱,从吸附柱下端进、从上端流出进入收集装置,按照时间点分别为10,30,60,90,120,180,240和300 min取样并测出剩余金属离子浓度。溶液中金属离子浓度达到初始浓度10%的时刻t为磁性芦荟青皮生物炭的穿透时间,溶液中的金属离子浓度达到初始浓度90%的时刻t为磁性芦荟青皮生物炭的饱和时间。
1.3.4 再生吸附
将50 mg的FSBC3-1放入金属离子溶液(300 mg·L-1)中,吸附1440 min后测定溶液中剩余金属离子的浓度。然后用0.01 mol·L-1 HCl 解析并回收已吸附的金属离子和生物炭,将回收的生物炭放在60℃的真空干燥箱中烘干,用其重复吸附初始浓度为300 mg·L-1的金属离子,如此重复5次。生物炭吸附剂的再生效率为[29]
式中q1 (mg·g-1)为吸附剂首次吸附量;qn (mg·g-1)为吸附剂再生第n次时的吸附量。
2 结果和讨论
2.1 炭材料表面的形貌
图1a~c分别给出了不同质量比(AL:FeSO4)的FSBC x-y 的SEM照片。可以看出,这种生物质炭材料的表面都有层状堆叠。与FSBC1-1和FSBC2-1相比,FSBC3-1的表面层状堆叠最复杂,其层状和粗糙程度最低,暴露出更多的活性基团。随着FeSO4用量的增加,炭材料表面的金属沉积越来越明显,表面的颗粒感越来越强。其可能的原因是,金属离子附着在FSBC x-y 表面堵塞了炭材料的孔道 [30]。这有利于吸附金属离子的活性基团包裹在炭材料内部,但是不利于炭材料对金属离子的吸附。随着FeSO4用量的减少,炭材料表面的层状堆叠更加明显,金属沉积程度降低、暴露出更多的活性基团,这时炭材料种更多的孔道打开,有利于吸附质进入炭材料内部与活性基团接触,有利于炭材料对金属离子的吸附。图1d,e分别给出了FSBC3-1吸附Ni2+和Co2+后的SEM照片。吸附金属离子后大量雾凇状物质附着在FSBC3-1的表面,是吸附后的Ni2+和Co2+均匀地分布在FSBC3-1表面所致。
图1
图1
FSBC x-y 的SEM照片
Fig.1
SEM images of FSBC x-y (a) FSBC1-1, (b) FSBC2-1, (c) FSBC3-1, (d) FSBC3-1-Ni2+, (e) FSBC3-1-Co2+
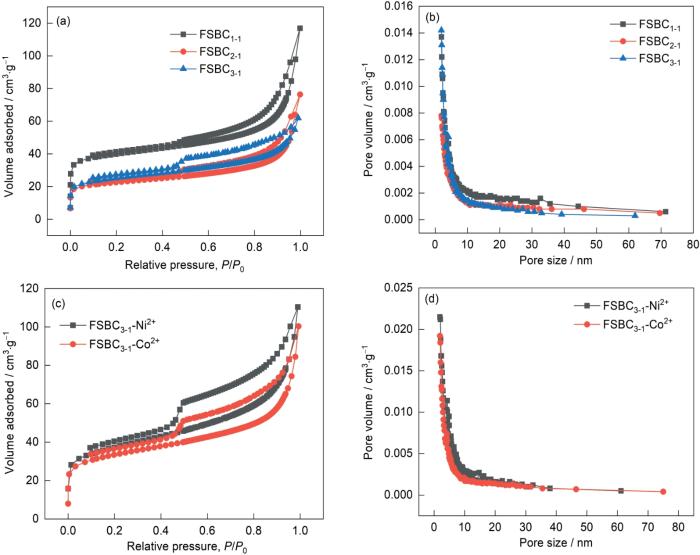
2.2 FSBC x-y 的N2 吸脱附曲线图和孔径分布
表1中的Dap为平均孔径;SBET为比表面积;Smic为微孔比表面积;Vt为总孔体积;Vmic为微孔体积;Non- Vmic/Vt为非微孔孔容与总孔积之比。
表 1 FSBC x-y 的比表面积和孔结构参数
Table 1
| Samples | Dap / nm | SBET / m2·g-1 | Smic / m2·g-1 | Vt / cm3·g-1 | Vmic / cm3·g-1 | Non-Vmic / Vt |
|---|---|---|---|---|---|---|
| FSBC1-1 | 5.71 | 126 | 91 | 0.15 | 0.06 | 0.60 |
| FSBC2-1 | 6.55 | 72 | 47 | 0.10 | 0.03 | 0.70 |
| FSBC3-1 | 4.69 | 82 | 56 | 0.10 | 0.04 | 0.60 |
| FSBC3-1-Ni2+ | 5.55 | 123 | 72 | 0.17 | 0.06 | 0.65 |
| FSBC3-1-Co2+ | 5.75 | 108 | 71 | 0.13 | 0.05 | 0.62 |
图2
图2
FSBC x-y 的N2吸脱附曲线图和孔径分布图
Fig.2
N2 adsorption-desorption isotherm and pore size distribution of FSBC x-y (a) and (c) N2 adsorption-desorption isotherm, (b) and (d) pore size distribution
表1列出了FSBC x-y 的比表面积和孔隙结构参数。表1中的数据表明,随着FeSO4的质量比的降低吸附剂的比表面积和总孔体积也随之减小。其原因可能是,FeSO4的质量比较高时Fe2+和Fe3+沉积在FSBC x-y 表面形成了一种疏松多孔的形状,使比表面积和总孔体积较大。这导致炭材料表面的活性基团数量减少,降低其吸附能力。与吸附前的FSBC3-1相比,吸附Ni2+和Co2+后FSBC3-1的平均孔径、比表面积、微孔比表面积、总孔体积、微孔体积都明显增加。其原因是,FSBC3-1表面的活性基团通过一系列反应将金属离子吸附在炭材料表面并在表面生成一层疏松多孔的雾凇状物质。这和Fe2+和Fe3+在炭材料表面沉积类似,与SEM观察的结果相符。
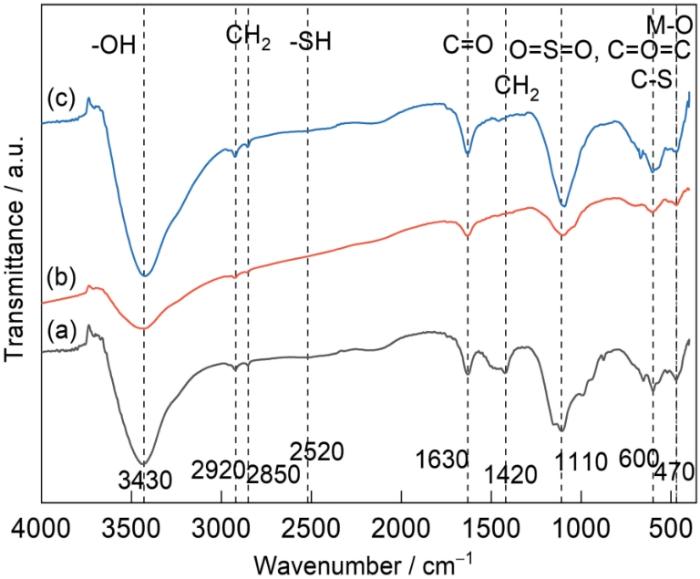
2.3 FTIR分析
图3给出了FSBC3-1吸附前后的FTIR谱。图3中3430 cm-1附近的强吸收峰是-OH的伸缩振动引起的,FSBC3-1吸附Ni2+后吸收峰强度明显降低,但是FSBC3-1吸附Co2+后吸收峰的强度没有明显的变化。这表明,只有Ni2+参与了与-OH的离子交换和络合作用等化学吸附行为而削弱了相关基团的吸收峰。在2920 cm-1,2850 cm-1和1420 cm-1处出现的吸收峰是CH2的反对称伸缩、对称伸缩和变形引起的,吸附Ni2+和Co2+后明显减弱,因为芳香族化合物的π电子与Ni2+和Co2+的稳定结合降低了吸收峰强度。在2520 cm-1出现的吸收峰是巯基(-SH)伸缩振动引起的,FSBC3-1吸附Ni2+后出现明显的变化,而吸附Co2+后未出现明显变化,表明-SH与Ni2+发生了一定的离子交换[31]。在1640 cm-1附近的吸收峰是由羧、醛和酮基中的-C=O的伸缩震动引起,FSBC3-1吸附Ni2+后吸收峰强度明显变化,但是FSBC3-1吸附Co2+后吸收峰的强度没有明显的减弱和偏移,是Ni2+与-COOH发生离子交换和络合等化学吸附行为引起的。在1110 cm-1附近的吸收峰是脂基、酸酐(C-O-C)和砜基(O=S=O)的伸缩震动引起,表明在FSBC3-1中掺杂了S元素。FSBC3-1吸附Ni2+和Co2+后这个峰明显偏移,可能是相关的活性基团参与了吸附过程[32]。在600 cm-1附近出现的吸收峰是C-S键的伸缩震动引起,FSBC3-1吸附Ni2+和Co2+后发生明显偏移,因为含S活性基团参与了吸附过程。在470 cm-1附近出现的吸收峰是M-O金属氧化峰引起,表明在FeSO4中引入了Fe2+和Fe3+。FSBC3-1吸附Ni2+和Co2+后吸收峰明显增强和偏移,是Ni-O和Co-O的形成所致。
图3
图3
FSBC3-1的FTIR图
Fig.3
FTIR spectrum of FSBC3-1 (a) FSBC3-1, (b) FSBC3-1-Ni2+, (c) FSBC3-1-Co2+
2.4 Zeta电位
图4给出了FSBC3-1的Zeta电位。可以看出,pH值小于等于3时FSBC3-1都带正电荷,与正价金属离子的静电相斥使FSBC3-1表面的活性位点和活性基团与Ni2+和Co2+不能接触,不能发生吸附。随着pH值的增大FSBC3-1表面的电荷由正变负,与正价金属离子的静电异性相吸使吸附行为发生。FSBC3-1的pHPZC为4.04,表明FSBC3-1在pH大于4.04时表面带负电荷,有利于吸附水中的金属离子,如Ni2+,Co2+等。
图4
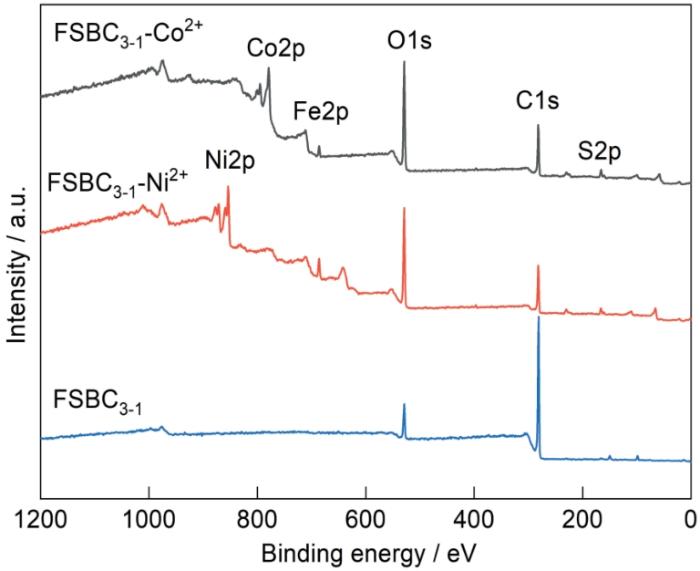
2.5 XPS分析
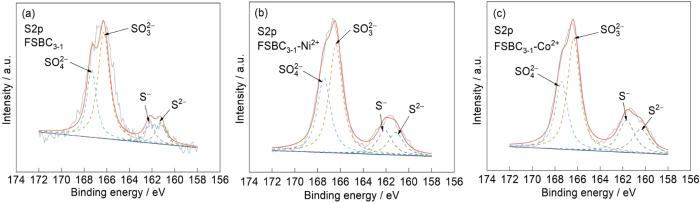
图5给出了FSBC3-1吸附前后的XPS全谱。可以看出,FSBC3-1含O、S和Fe元素,C1s,O1s,S2p和Fe2p的宽谱峰分别出现在281,529,166和708 eV。FeSO4的掺杂使FSBC3-1的全谱中出现了明显的S2p和Fe2p宽谱峰。C、O、S和Fe组成的活性基团在化学吸附中起重要作用。FSBC3-1吸附Ni2+和Co2+后在全谱的854和779 eV处出现了明显的Ni2p和Co2p宽谱峰。由表2可见,吸附Ni2+和Co2+后各元素含量的比例出现了明显的变化。其原因是,含C、O、S和Fe的活性基团参与了吸附过程且其含量大幅度下降,从而使元素的比例发生变化,表明存在化学吸附。吸附后FSBC3-1-Ni2+表面Ni2p的含量为35.80%,FSBC3-1-Co2+表面Co元素的含量为25.50%,表明FSBC3-1吸附了Ni2+和Co2+。
图5
表2 XPS分析元素摩尔分数
Table 2
| Samples | C1s | O1s | S2p | Fe2p | Ni2p | Co2p |
|---|---|---|---|---|---|---|
| FSBC3-1 | 87.20 | 11.10 | 1.00 | 0.70 | - | - |
| FSBC3-1-Ni2+ | 27.30 | 27.70 | 5.50 | 3.70 | 35.80 | - |
| FSBC3-1-Co2+ | 29.30 | 34.70 | 9.70 | 0.80 | - | 25.5 |
图6
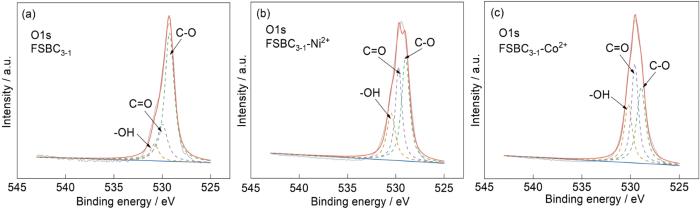
表3 XPS分析中O1s、N1s和Co2p谱图的官能团摩尔分数
Table 3
| sample | C-O | C=O | -OH | S2- | S- | SO | SO | Fe2+ | Fe3+ |
|---|---|---|---|---|---|---|---|---|---|
| FSBC3-1 | 69.55 | 22.25 | 8.20 | 9.10 | 8.79 | 53.71 | 53.71 | 49.90 | 50.10 |
| FSBC3-1-Ni2+ | 44.73 | 33.46 | 21.81 | 10.90 | 11.50 | 45.70 | 45.70 | 54.70 | 45.30 |
| FSBC3-1-Co+ | 36.65 | 37.75 | 25.60 | 12.80 | 16.20 | 44.10 | 44.10 | 51.40 | 48.60 |
图7
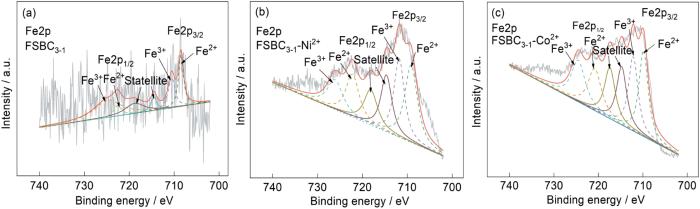
图8给出了FSBC3-1吸附Ni2+和Co2+前后的Fe2p谱图。根据Fe2p谱和表3中数据,Fe2p谱图中708.48和722.6 eV附近的峰是因为Fe2+的生成,710.56和724.79 eV附近的峰是因为存在Fe3+。这表明,在FSBC3-1中掺杂了FeSO4并且生成了Fe2+和Fe3+。而产生Fe3+的原因是,FeSO4和芦荟青皮在空气中在200℃水热时,其中的部分Fe2+氧化为Fe3+[33]。位于714和718 eV附近的峰是两个卫星峰。FSBC3-1吸附Ni2+和Co2+后FSBC3-1表面Fe2+和Fe3+的含量比例发生了一定的变化。FSBC3-1吸附Ni2+和Co2+后Fe3+的含量比例都有所下降,表明Fe3+有利于对Ni2+和Co2+的吸附,也表明FeSO4的掺杂引入了含S和Fe的活性基团。
图8
2.6 FSBC3-1 的磁性
图9
2.7 吸附等温线
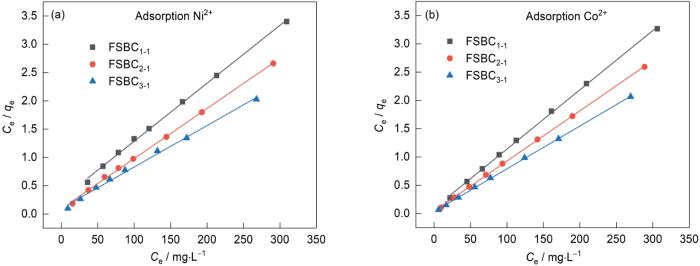
图10给出了FSBC x-y 吸附Ni2+和Co2+的吸附等温线。可以看出,FSBC x-y 对Ni2+,Co2+的吸附性能较好,其中FSBC3-1的吸附性能最佳。金属离子的初始浓度较低时FSBC3-1的吸附等温线斜率较高,表明FSBC3-1对金属离子的平衡吸附量较低,但是对金属离子去除率较高。其原因是,FSBC3-1含有较多的活性位点和活性基团能与金属离子充分接触;随着金属离子溶液初始浓度的提高吸附等温线趋于平衡,斜率降低。其原因是,金属离子与FSBC3-1表面的活性位点和活性基团充分结合后,FSBC3-1孔道内的活性位点和活性基团开始与其接触,FSBC3-1的吸附容量逐渐增加,但是去除率逐渐降低;FSBC3-1所有的孔道被占满以及活性位点和活性基团逐渐消耗完,吸附也逐渐达到饱和,此时再提高金属离子的初始浓度FSBC3-1的吸附量也不会提高。
图10
图11
图11
FSBC x-y 的Langmuir拟合模型
Fig.11
Linear fitting of Langmuir model for FSBC x-y
图12给出了FSBC x-y 的去除率曲线,可见FSBC3-1吸附低Ni2+和Co2+浓度溶液时去除率较高(接近100%);随着溶液浓度的提高去除率越来越低,FSBC3-1吸附逐渐趋于饱和。这表明,FSBC3-1对低浓度金属离子废水的吸附能力较强。
图12
2.8 吸附动力学
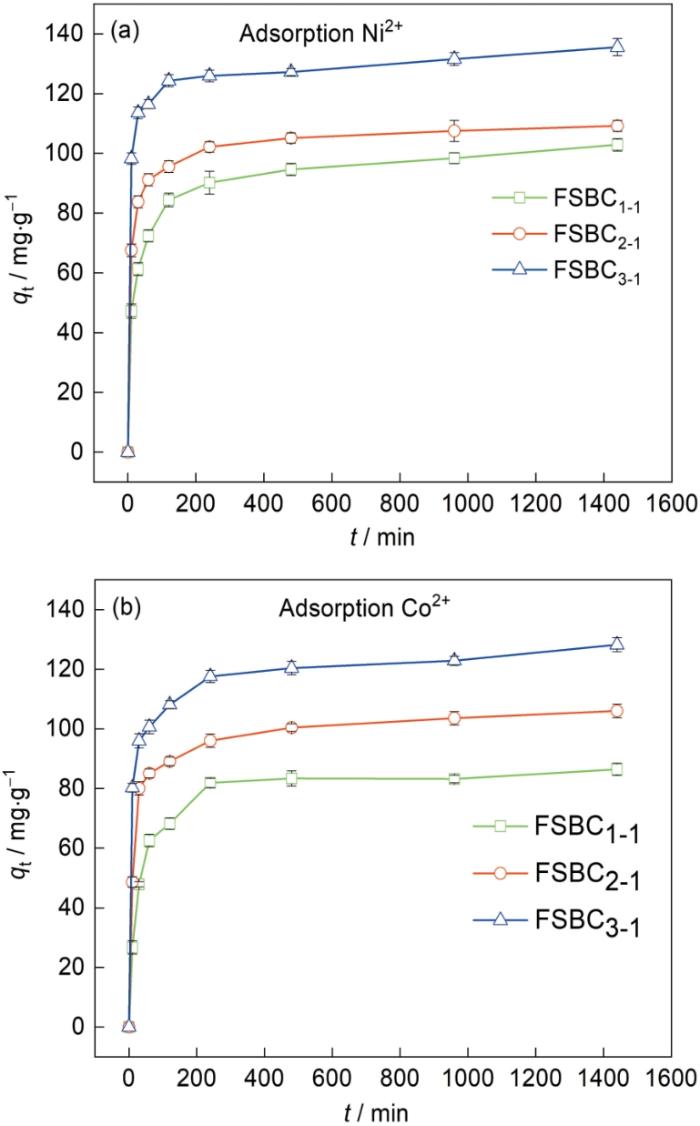
图13给出了FSBC x-y 吸附Ni2+和Co2+的吸附动力学曲线。从图13可以看出,在100 min内FSBC x-y 对Ni2+和Co2+的吸附速率较高。其原因是,吸附的前期FSBC x-y 表面丰富的活性位点和活性基团与溶液中的金属离子充分结合;吸附100-200 min吸附速率逐渐降低,吸附200 min吸附开始达到平衡。达到平衡的原因是,溶液中的金属离子完全占据FSBC x-y 表面的活性位点和活性基团后金属离子进入FSBC x-y 内部与孔道内的活性位点和活性基团接触,并发生化学吸附行为;吸附200 min后FSBC x-y 表面和内部孔道的活性位点被金属离子完全占据并达到饱和状态,使吸附达到平衡状态。
图13
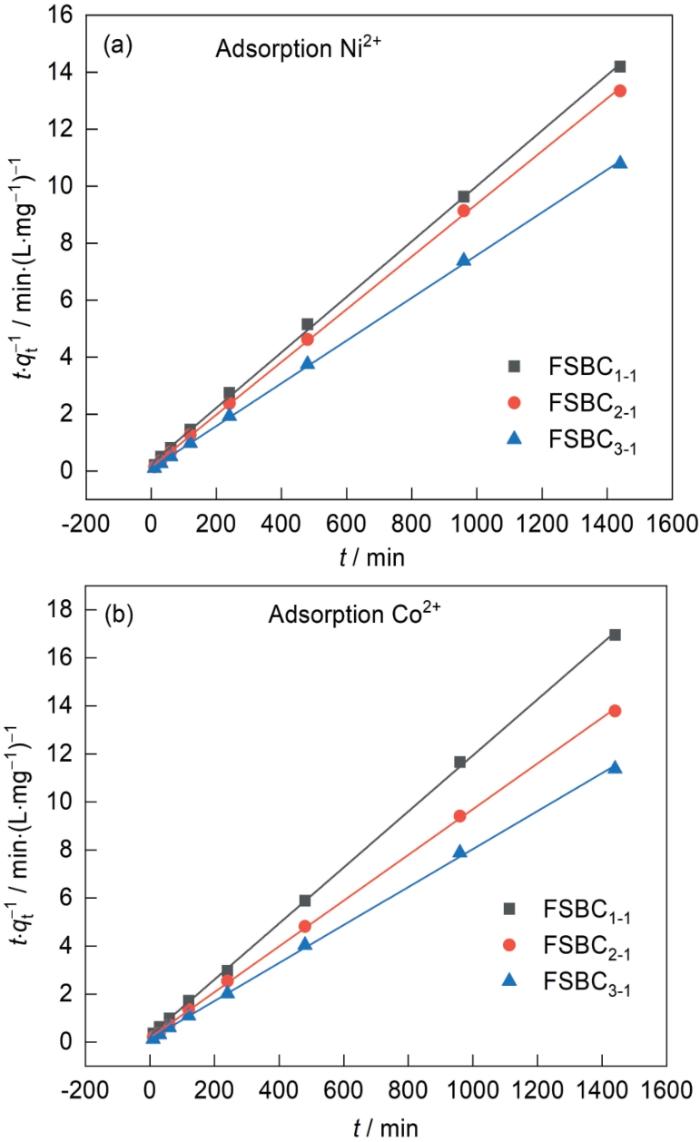
图14给出了FSBC x-y 吸附Ni2+和Co2+的拟二级动力学模型。可以看出,拟二级动力学模型能更好的描述FSBC x-y 对Ni2+和Co2+的吸附行为(相关系数R2 > 0.9993),表明FSBC x-y 对金属离子的吸附主要是化学吸附[36]。根据拟二级模型可计算出FSBC3-1对Ni2+和Co2+的平衡吸附容量分别为133.33 mg·g-1和126.42 mg·g-1。与FSBC1-1和FSBC2-1相比,FSBC3-1的吸附性能最佳。这一结果与吸附等温线实验结果相近,也与FTIR和XPS分析的结果一致。
图14
图14
FSBC x-y 的吸附动力学拟合图
Fig.14
Linear fitting of adsorption kinetics of FSBC x-y
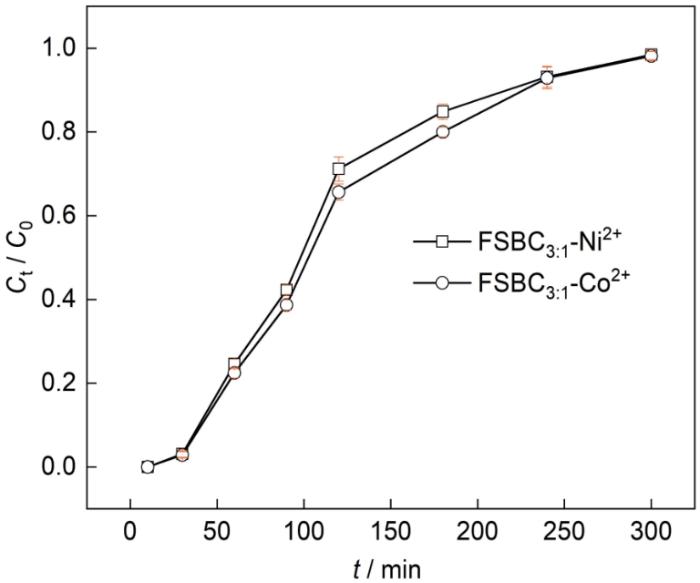
2.9 固定床吸附
图15
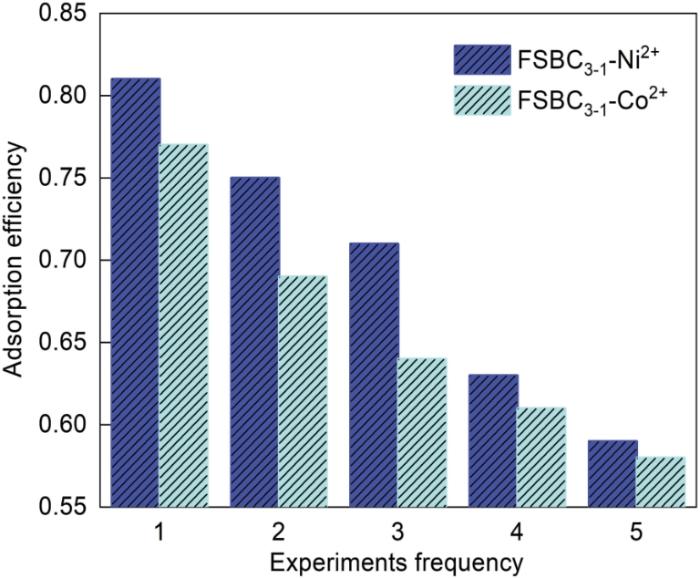
2.10 生物炭的再生
图16
图16
FSBC3-1的再生吸附效率图
Fig.16
Regeneration adsorption efficiency curve of FSBC3-1
2.11 溶液的pH值对吸附的影响
图17给出了溶液的pH值对FSBC3-1吸附Ni2+和Co2+的影响。可以看出,随着溶液pH值的增加FSBC3-1对Ni2+和Co2+的吸附量随之增加。溶液的pH值为1时,FSBC3-1对Ni2+和Co2+的吸附量几乎为0。其原因是,在强酸溶液中FSBC3-1表面产生了大量的正电荷,与正价金属离子间静电相斥使FSBC3-1表面的活性位点和活性基团与Ni2+和Co2+不能接触和吸附。随着溶液的pH值提高到2-7吸附量缓慢增长,吸附量与吸附等温线和吸附动力学的结果接近。当pH值高于超过7时,FSBC3-1对Ni2+和Co2+的吸附量骤增。因为在碱性溶液中FSBC3-1表面的大量负电荷与正价金属离子间的静电相吸有助于吸附行为的发生。同时,碱性溶液中的的OH-与部分Ni2+和Co2+产生了共沉淀反应,降低了溶液中金属离子的浓度。当pH值大于10时溶液里的Ni2+和Co2+几乎完全沉淀。这一实验结果与Zeta电位分析中结果一致。
图17
2.12 竞争吸附
图18给出了FSBC3-1的金属离子竞争吸附柱状图,表4列出了竞争吸附的分配系数。图18和表4中的数据表明,在Ni2+和Co2+的单元体系吸附中FSBC3-1对Ni2+和Co2+单一的分配系数分别为0.74 L·g-1和0.76 L·g-1;在Ni2+-Co2+的二元体系中Ni2+和Co2+的分配系数分别为0.39 L·g-1和0.34 L·g-1。两种金属离子的分配系数接近,FSBC3-1对Ni2+比Co2+有更好的选择性;在Ni2+-Zn2+的二元体系中,Ni2+和Zn2+的分配系数分别为0.17 L·g-1和0.58 L·g-1,表明FSBC3-1对Zn2+有更好的选择性;在Co2+-Zn2+的二元体系中,Co2+和Zn2+的分配系数分别为0.06 L·g-1和0.49 L·g-1,表明FSBC3-1对Zn2+有更好的选择性;在Ni2+-Co2+-Zn2+的三元体系中,Ni2+、Co2+和Zn2+的分配系数分别为0.08 L·g-1,0.16 L·g-1和0.58 L·g-1,表明FSBC3-1对Zn2+有更好的选择性。多元体系的金属离子的竞争吸附结果表明,FSBC3-1对Zn2+的选择性更高,即Zn2+对FSBC3-1吸附Ni2+和Co2+的影响较大。但是,对于三种金属离子的吸附量都优于其他生物炭的吸附容量。
图18
图18
FSBC3-1的金属离子竞争吸附图
Fig.18
Competitive adsorption map of metal ions for FSBC3-1
表4 FSBC3-1的金属离子竞争吸附分配系数
Table 4
| Metal ion | Single | Binary | Ternary | ||
|---|---|---|---|---|---|
| Ni2+-Co2+ | Ni2+-Zn2+ | Co2+-Zn2+ | Ni2+-Co2+-Zn2+ | ||
| Ni2+ | 0.74 | 0.39 | 0.17 | - | 0.08 |
| Co2+ | 0.76 | 0.34 | - | 0.06 | 0.16 |
| Zn2+ | - | - | 0.58 | 0.49 | 0.45 |
2.13 吸附机理
图19给出了FSBC x-y 吸附Ni2+和Co2+的机理,其中M代表Ni2+或Co2+。根据表征分析结果和吸附实验数据,FSBC x-y 具有一定大小的比表面积、丰富的活性位点和活性基团。FSBC x-y 吸附Ni2+和Co2+的机理,可能是FSBC x-y 表面的C、O、S和Fe活性基团参与了离子交换,产生了络合、共沉淀、静电、孔道或π-π作用。参与反应的主要活性官能团有羟基(-OH)、巯基(-SH)、砜基(O=S=O)、羧基(-COOH)等,其中羟基、巯基和羧基参与离子交换、静电作用等化学吸附行为,羧基和砜基参与络合作用等化学吸附行为。在-OH的作用下,Ni2+和Co2+生成氢氧化物沉淀在FSBC x-y 表面。FTIR分析结果表明,FSBC x-y 可能存在芳香族化合物且其π电子可能与Ni2+和Co2+稳定结合。XPS分析结果表明,掺杂FeSO4引入了S元素,FSBC x-y 表面的含S活性基团有利于对Ni2+和Co2+的吸附。
图19
3 结论
FeSO4掺杂芦荟青皮的磁性生物炭FSBC x-y 表面具有层状堆叠结构,FSBC3-1的表面具有分级多孔结构,表面的层状堆叠最显著和复杂,层状较小,粗糙程度最低。FSBC3-1表面有丰富的C,O,S和Fe活性基团,与Ni2+和Co2+发生离子交换、络合、共沉淀、静电吸附、孔道、氢键和π-π等反应。FSBC3-1对Ni2+,Co2+的吸附过程符合Langmuir等温吸附模型。FSBC3-1对Ni2+和Co2+吸附过程符合拟二级动力学模型,吸附速率主要受FSBC3-1表面活性基团控制。FSBC3-1对金属离子有较大的动态吸附容量,还可循环使用。
参考文献
Fabrication of EVOH/PANI composite nanofibrous aerogels for the removal of dyes and heavy metal ions
[J].
ecofriendly approach for treatment of heavy-metal-contaminated water using activated carbon of kernel shell of oil palm
[J].
Experimental modelling studies on the removal of dyes and heavy metal ions using ZnFe2O4 nanoparticles
[J].
A novel cationic polyelectrolyte microsphere for ultrafast and ultra-efficient removal of heavy metal ions and dyes
[J].
Activated carbon (AC)-metal-organic framework (MOF) composite: Synthesis, characterization and dye removal
[J].
Metal-organic and Zeolitic imidazole frameworks as cationic dye adsorbents: physicochemical optimizations by parametric modeling and kinetic studies
[J].
Adsorption of reactive blue-13, an acidic dye, from aqueous solution using magnetized activated carbon
[J].
Adsorption of congo red dye using metal oxide nano-adsorbents: Past, present, and future perspective
[J]. In.
Amorphous tetrazine-triazine-functionalized covalent organic framework for adsorption and removal of dyes
[J].
Preparation and characterization of strong cation exchange terpolymer resin as effective adsorbent for removal of disperse dyes
[J].In this study, (hydroxypropylmethacrylate-co-ethyleneglycol dimethacrylate-co-glycidylmetharylate) terpolymer resin functionalized with sulfonic acid groups was prepared and used as cation exchange resin for removal of two different disperse dyes (i.e., Direct Red R [DR-R] and Disperse Violet 28 [DV-28]) from aqueous solution. The properties of the adsorbent were determined using Fourier transform infrared, dynamic light scattering, scanning electron microscopy, and Brunauer, Emmett, and Teller methods. The maximum adsorption capacity of the resin for the DR-R and DV-28 was found to be 86.1 and 179.6 mg/g, respectively. Desorption study was realized to evaluate the reusability of the resin and the percent desorption from the resin for DR-R and DV-28 dyes was found to be approximately 89.4% and 91.7%, respectively. The experimental data were evaluated using different kinetics and isotherm models. These results show that the experimental data could be designated with the second-order kinetic model and both Langmuir and Temkin isotherm models. Finally, the presented resin was able to remove large amounts of organic pollutants in a short process time with a low amount of adsorbent. Thus, it was shown that the prepared resin has high potential for use as an effective and sustainable adsorbent for the treatment of industrial wastewater. POLYM. ENG. SCI., 2019. (c) 2019 Society of Plastics Engineers
Study on the dye removal from aqueous solutions by graphene-based adsorbents
[J].
New activated carbon from mine coal for adsorption of dye in simulated water or multiple heavy metals in real wastewater
[J].
Applications of biochar and modified biochar in heavy metal contaminated soil: A descriptive review
[J].
Application of biochar for the adsorption of organic pollutants from wastewater: Modification strategies, mechanisms and challenges
[J].
Activated carbon obtained from amazonian biomass tailings (acai seed): Modification, characterization, and use for removal of metal ions from water
[J].
Adsorptive efficiency of hull-based activated carbon toward copper ions (Cu2+) removal from aqueous solution: Kinetics, modelling and statistical analysis
[J].
Timothy Tiwonge Biswick, adsorption of chromium ions from tannery efuents onto activated carbon prepared from rice husk and potato peel by H3PO4 activation
[J].
Toxic metal adsorption from aqueous solution by activated biochars produced from macadamia nutshell waste
[J].
Evaluation of cephalexin and amoxicillin removal from aqueous media using activated carbon produced from aloe vera leaf waste
[J].
Exhaustive studies on toxic Cr(VI) removal mechanism from aqueous solution using activated carbon of aloe vera waste leaves
[J].
Preparation and application in water treatment of magnetic biochar
[J].
Applications of functionalized magnetic biochar in environmental remediation: A review
[J].
Magnetic biochar derived from sewage sludge of concentrated natural rubber latex (CNRL) for the removal of Al3+ and Cu2+ ions from wastewater
[J].In order to reduce sewage sludge of concentrated natural rubber latex (CNRL) and transform it into a valuable material for efficient removal of Al3+ and Cu2+ ions from wastewater, magnetic biochar was prepared. In this work, sewage sludge from CNRL was pyrolyzed at various temperatures (300-700 degrees C) to assess the effects of pyrolysis temperature on the efficiency of magnetic biochar in removing Al3+ and Cu2+ ions from an aqueous medium. Effect of the chemical composition of sewage sludge on the biochar characteristic was evaluated. Sewage sludge is mainly organic matter. The mineral elements silicon (Si), phosphorus (P), sulfur (S) and calcium (Ca) were also observed in the sewage sludge. With increasing pyrolysis temperature, the contents of P and potassium (K) increased. The inorganic metals chromium (Cr), copper (Cu), manganese (Mn), nickel (Ni) and lead (Pb) were present in small quantities. Pyrolysis temperatures 400-500 degrees C provided good quality magnetic biochar, while with the higher 700 degrees C pyrolysis temperature, specific surface area and pore volume decreased. The prepared biochar had combined meso- and macro-porous structure. Isotherms of Type II were indicating multilayer adsorption on porous biochar. The pseudo-second-order kinetic models described well Al3+ and Cu2+ adsorption onto magnetic biochar. The leaching test of magnetic biochar shows the releasing of K and Zinc (Zn) which can effect on the sorption of Al3+ and Cu2+. The binding mechanism between magnetic biochar and Al3+/Cu2+ involved surface complexation, ion exchange and cation-pi interaction. Graphic abstract
Adsorptive removal of fluoride ions from aqueous solution using activated carbon supported tetrametallic oxide system
[J].