纳米级氧化铁具有独特的物理和化学特性,已经用于生物医学领域,例如核磁共振,免疫检测和生物分子提取等[1~5]。理想的纳米材料,应该结构清晰、性能稳定和分散性高。纳米级氧化铁的物理和化学性质,与其化学组成、尺寸、形态以及分散性等因素有密切的关系[6~10]。现在,用不同方法制备尺寸和形貌可控的纳米氧化铁,是该领域的研究热点。目前制备纳米氧化铁的主要方法,有化学共沉淀法和热解前驱体法[11~16]。热解前驱体法的产物品控能力极高,产物的纯度高、分散性好、晶形好且可控制。邵鹏辉[17]以乙酰丙酮铁作为前驱体,用二氧化硅水凝胶抑制氧化铁(110)晶面的生长,在水热体系中制备出了纳米氧化铁;李杰[18]等以氯化铁、甘油和尿素为反应物,先用水热法制备出FeOOH,再将其在500℃煅烧制备出α-Fe2O3;钟鑫[19]以氯化铁和乙二胺四乙酸二钠为反应物并加入适量的表面活性剂,在水热体系中制得FeOOH,再将其在300℃马弗炉中煅烧2 h制备出球状纳米氧化铁。为了简化制备工艺,本文用热解前驱体法一步制备一种新型球状纳米氧化铁。
1 实验方法
1.1 实验用原料
(1)九水硝酸铁(Fe(NO3)3·9H2O),无色至暗紫色的潮解性晶体,易潮解,易溶于水,分子量404。(2)尿素,又称碳酰胺(CH4N2O),白色晶体,易溶于水,加热至160℃以上时分解产生氨气,分子量为60。
1.2 纳米氧化铁粉末的制备和表征
将不同量(分别为1.3 g、1.7 g、2.1 g和2.5 g)的九水硝酸铁(Fe(NO3)3·9H2O)放入盛有100 mL去离子水的烧杯中使其溶解,用磁力搅拌器将其搅拌5 min形成淡黄色溶液,再在其中加入2.5 g的尿素继续搅拌5 min。待得到的溶液搅拌均匀后将其倒入高压反应釜中密封,然后放在不同温度(分别为160℃、180℃、200℃和220℃)的恒温干燥箱中恒温处理12 h。热处理结束后将其自然冷却至室温,将得到的样品分别用去离子水和无水乙醇充分冲洗后抽滤。将得到的产物放入80℃真空干燥箱内干燥6 h,即得到纳米氧化铁粉末。
2 结果和讨论
2.1 样品的晶相分析和形貌
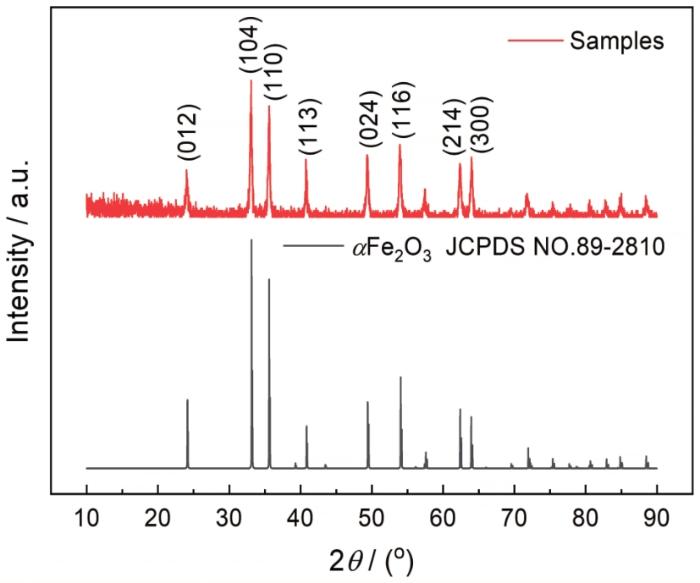
图1给出了纳米氧化铁粉末样品的XRD谱。在谱中可发现各衍射峰的峰位与三方系α-Fe2O3标准图谱的峰位完全吻合。这表明,制备出的样品为纯度较高的α-Fe2O3。
图1
图1
纳米氧化铁样品的XRD谱
Fig.1
XRD spectrum of the prepared nanometer iron oxide sample
图2给出了纳米氧化铁样品的SEM照片,可见氧化铁颗粒的粒径比较均匀,排列比较致密,只有轻微的堆积。氧化铁颗粒为球形,直径约为40 nm~60 nm,个别较大的颗粒其直径约为80 nm。
图2
2.2 样品EDS分析
图3给出了纳米氧化铁样品的EDS分析图。可以看出,EDS谱中有明显的Fe峰和O峰,没有杂峰,说明制备出的纳米氧化铁纯度较高。
图3
2.3 水热反应温度的影响
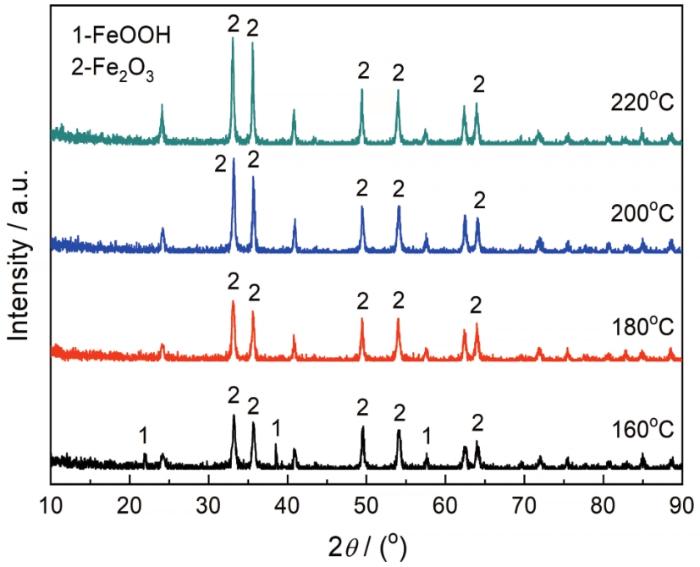
图4给出了水热反应温度分别为160℃、180℃、200℃和220℃制备的样品的XRD谱。水热反应温度为160℃的产物主要为α-Fe2O3,并混有FeOOH相(图中标有1处)。α-Fe2O3的衍射峰强度较弱,说明α-Fe2O3的结晶强度较弱。水热反应达到180℃时FeOOH的衍射峰完全消失,产物为纯相α-Fe2O3,衍射峰强度比水热反应为160℃时有所增强。随着水热反应的提高α-Fe2O3的衍射峰强度逐步提高,水热反应达到200℃时衍射峰强度基本上达到最高,与220℃时的衍射峰强度基本一致。这表明,水热反应对制备纯相α-Fe2O3有较大的影响。水热反应达到200℃时,产物为结晶度较高的纯相α-Fe2O3。
图4
图4
在不同反应温度制备的样品XRD谱
Fig.4
XRD analysis of samples prepared at different reaction temperatures
图5
图5
在不同反应温度制备的样品的SEM照片
Fig.5
SEM images of samples prepared at different reaction temperatures (a) 160℃, (b) 180℃, (c) 200℃, (d) 220℃
表1 在不同温度下制备的样品的粒径
Table 1
| Grain | Fig.a/nm | Fig.b/nm | Fig.c/nm | Fig.d/nm |
|---|---|---|---|---|
| 1 | 43 | 51 | 60 | 63 |
| 2 | 42 | 53 | 58 | 59 |
| 3 | 50 | 55 | 59 | 62 |
| 4 | 40 | 54 | 62 | 63 |
| 5 | 41 | 51 | 58 | 65 |
| 6 | 41 | 52 | 60 | 64 |
| 7 | 40 | 54 | 59 | 63 |
| 8 | 43 | 52 | 58 | 65 |
| 9 | 42 | 51 | 63 | 61 |
| 10 | 41 | 55 | 63 | 64 |
| Average | 42.35 | 52.10 | 60.05 | 63.00 |
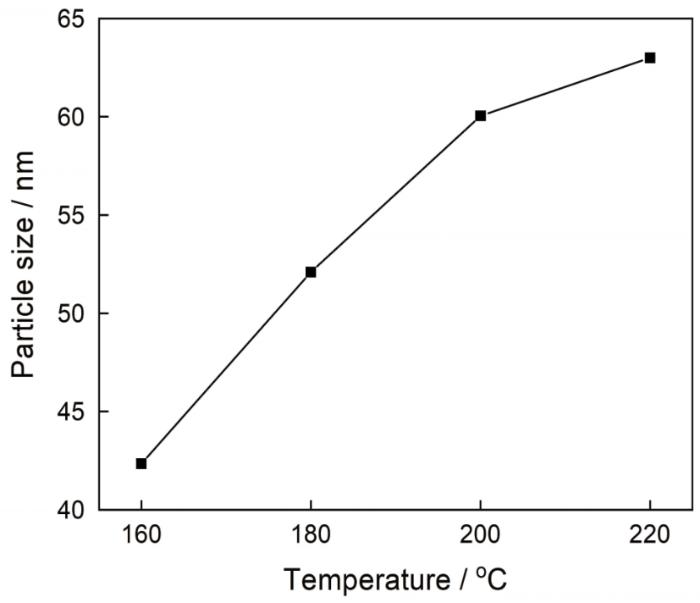
图6
图6
在不同反应温度制备的样品的粒径
Fig.6
Size of sample prepared at different reaction temperature
2.4 反应物用量对纳米氧化铁形貌的影响
为了探索原料量对氧化铁形貌的影响,实验还设置了Fe(NO3)3·9H2O的不同用量,分别为1.3 g、1.7 g、2.1 g和2.5 g,反应温度设定为200℃,其他实验条件保持不变。
图7
图7
反应物用量不同的样品的SEM照片
Fig.7
SEM of samples with different reactants (a) 1.3 g, (b) 1.7 g, (c) 2.1 g, (d) 2.5 g
表2 实验中制备的纳米氧化铁的粒径
Table 2
| Grain | Fig.a/nm | Fig.b/nm | Fig.c/nm | Fig.d/nm |
|---|---|---|---|---|
| 1 | 53 | 56 | 51 | 54 |
| 2 | 54 | 53 | 53 | 50 |
| 3 | 53 | 55 | 56 | 53 |
| 4 | 55 | 55 | 54 | 54 |
| 5 | 54 | 53 | 57 | 56 |
| 6 | 53 | 56 | 52 | 55 |
| 7 | 54 | 54 | 56 | 56 |
| 8 | 53 | 55 | 52 | 56 |
| 9 | 49 | 52 | 51 | 52 |
| 10 | 53 | 55 | 55 | 55 |
| Average | 53.2 | 54.15 | 53.7 | 54 |
2.5 纳米氧化铁的生成机理
Fe(NO3)3·9H2O溶于水后,硝酸离子被取代生成六水络合离子[Fe(H2O)6]3+,然后六水络合离子发生羟化缔合反应,即与铁离子结合较强的羟基取代与铁离子结合较弱的水合离子,并通过羟基间羟桥配位聚合作用或氧桥合作用生成水解聚合物[20]。这些聚合物大多数是通过共用边或共用顶点的缩合而成的八面体Fe(O, OH, H2O)6的配合物,其反应式为
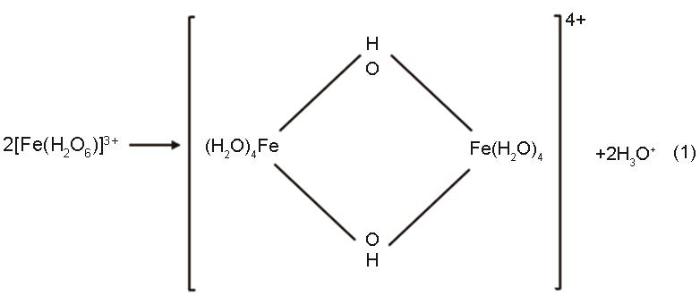
这些八面体配合物脱水后生成FeOOH,其反应式为
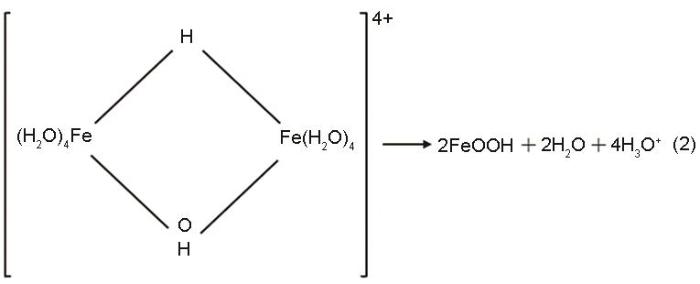
根据热力学分析,本文实验体系中的FeOOH处于热力学不稳定状态。而且高压釜内的压强随着温度的提高而增大,使FeOOH发生氧桥合而生成Fe2O3[21],其反应式为
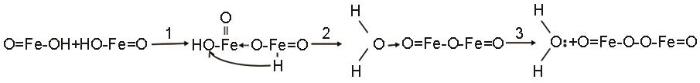
因此,在反应温度较低时,例如在160℃,在制备出的纳米氧化铁样品的XRD谱中有FeOOH的衍射峰,而当反应温度高于180℃时FeOOH的衍射峰完全消失,产物为纯相α-Fe2O3,且随着反应温度的提高样品的结晶度提高、粒度增大。
3 结论
(1) 以Fe(NO3)3·9H2O为初始原料并用尿素辅助,用热解前驱体法可制备一种新型球状纳米氧化铁。提高反应温度有利于提高纳米氧化铁的结晶度,反应温度为220℃时结晶度达到最大值。Fe(NO3)3·9H2O溶液的浓度对纳米氧化铁样品的粒度和形貌没有太大的影响。
(2) 随着温度的提高纳米氧化铁样品的粒径随之增大。反应温度由160℃提高到200℃样品的粒径明显变化,反应温度由200℃提高到220℃样品粒径的变化较小。
参考文献
Superparamagnetic iron oxide nanoparticles (SPIONs): Development, surface modification and applications in chemotherapy-science direct
[J].
Magnetic hyperthermia with magnetite nanoparticles: electrostatic and polymeric stabilization
[J].
Recent advances in iron oxide nano-materials for tumor treatment
[J].
氧化铁纳米材料在肿瘤治疗中的研究进展
[J].
Janus magnetic-plasmonic nanoparticles for magnetically guided and thermally activated cancer therapy
[J].
Iron oxide nanospheres and nanocubes for magnetic hyperthermia therapy: A comparative study
[J].
Shape-controlled synthesis and application of nano-iron oxides with multiple morphologies
[D].
多种形貌纳米铁氧化物的控制合成及应用研究
[D].
Preparation and application of Fe3O4 Nanomaterials
[J].
四氧化三铁纳米材料的制备与应用
[J].近年来磁性Fe<sub>3</sub>O<sub>4</sub>纳米材料因其独特的物理化学性质如量子尺寸效应、表面界面效应、电学特性以及磁学特性等,而引起了广泛的研究,并在诸多领域(如环境、能源)具有潜在应用前景。本文总结了近年来国内外制备Fe<sub>3</sub>O<sub>4</sub>的一些方法,主要包括:沉淀法、热分解法、水热法、微乳液法以及溶胶-凝胶法,同时对各种制备方法的优缺点进行了比较。在应用方面,着眼于Fe<sub>3</sub>O<sub>4</sub>良好的磁响应性,综述了Fe<sub>3</sub>O<sub>4</sub>纳米材料及其复合物作为吸附剂用于去除废水中的金属离子以及有机污染物;系统总结了Fe<sub>3</sub>O<sub>4</sub>在催化中的应用,包括其本身作为催化剂和作为催化剂活性组分(如贵金属纳米粒子、金属氧化物半导体纳米光催化剂、金属有机化合物等)的载体两个方面。另外,本文还介绍了Fe<sub>3</sub>O<sub>4</sub>纳米材料在能源存储(锂离子电池和超级电容器)以及生物医药(肿瘤诊疗、固定化酶和免疫分析)等方面的应用。最后,针对目前Fe<sub>3</sub>O<sub>4</sub>纳米材料在制备中存在的一些问题进行探讨并对今后的研究方向进行了展望。
Preparation and morphology analysis of nano-sized iron oxide
[J].
纳米氧化铁的制备及形貌分析
[J].
Preparation and magnetic properties of superparamagnetic iron oxide nanorods
[J].
超顺磁性氧化铁纳米棒的制备及磁性研究
[J].
Infrared and Raman spectroscopic studies on iron oxide magnetic nano-particles and their surface modifications
[J].
Hydrothermal liquefaction of three kinds of starches into reducing sugars
[J].
Synthesis of various morphological Ca0.75Er0.25-MnO3 powders by hydrothermal method and their electrical properties
[J].
Research progress of preparation methods of nano iron oxide
[J].
纳米氧化铁制备方法的研究进展
[J].
Research progress in preparation of nano-oxides by hydrothermal method
[J].
水热法制备纳米氧化物的研究进展
[J].
Preparation and morphology of nano-sized ferric oxide (Fe3O4)
[J].
Synthesis and size control of the Fe3O4 particles synthesized by a reverse coprecipitation method
[J].
反向共沉淀法制备纳米Fe3O4及其粒径控制
[J].
Optimizing synthesis of iron oxide nano-materials for applicatiomferro in photo-fenton degradation of bispheonls under visible light irradiation
[D].
纳米氧化铁的优化制备及其可见光芬顿降解水中的双酚S
[D].
Synthesis of α-Fe2O3 nanomaterials and its application in photocatalysis
[J].
α-Fe2O3纳米材料的合成及其在光催化中的应用
[J].
Morphology controll synthesis and gas sensing properties of nano-iron oxide
[D].
纳米氧化铁的形貌控制合成及气敏性能研究
[D].
Growth mechanisms of iron oxide particles of differing morphologies from the forced hydrolysis of ferric chloride solutions
[J].