钛酸钡(BaTiO3,简称为BT)具有典型的钙钛矿结构,是一种具有高介电、铁电性的无铅压电陶瓷。Yeong-JoonPark等[18]证明,极化后的BT负极表面吸附Ca2+、P5+形成的磷酸钙沉积层具有良好的生物活性。这种生物活性,为将BT用于医学和整形外科奠定了基础。
已有研究证实,HA-BT复合材料在电场中极化后能产生与骨组织类似的压电特性,没有细胞毒性且具有良好的生物相容性。Feng等[19]在犬的体内植入HA-BT生物压电陶瓷,结果表明:HA-BT陶瓷的压电特性显著增强了成骨作用,且其与极化方向有关。Tang等[20]制备出极化后产生压电性能的HA-BT复合材料,证明在循环载荷的作用下BT的压电作用促进了成骨细胞的生长和BT与HA之间的相互作用。Dubay等[21]使用多级火花等离子烧结制备HA-BT复合材料,提出BT粒子的存在使复合材料的机械性能(硬度和断裂韧性)和物理性能提高。还有研究工作[21,22]指出,HA和BT烧结时存在反应,但是没有解释反应过程以及反应产物对性能的影响。另外,由于HA-BT复合陶瓷材料的力学、电学性能与粒子尺寸相关,很多学者对此进行了研究。结果表明,与微米HA相比,纳米HA具有更好的生物可降解性、生物活性及生物相容性[23]。与传统陶瓷相比,纳米级晶粒能提高材料的强度、韧性及电学性能[24]。鉴于此,本文选用纳米级羟基磷灰石为原料,采用经济性好且可工业生产的常压烧结方法制备致密性HA- BT复合生物材料,研究其机械性能、电学性能以及与人骨基本参数的匹配性,分析烧结反应机理并探讨其对HA-BT复合材料力学性能和电学性能的影响。
1 实验方法
1.1 HA-BT复合材料样品的制备
实验用原料为商用HA纳米粉体(粒径为60~80 nm),和商用BT粉末(粒径小于0.29
将HA粉和BT粉按不同质量比(BT的含量分别为10%、30%、70%、90%)加入无水乙醇中,球磨12 h使之均匀混合并减小粒径。然后将混合后的原料粉末置于100℃干燥箱中烘干6 h并将其过筛。将过筛后的粉末模压后在45~50 MPa的压力下单轴挤压10 min,分别制备出直径为10 mm厚度为8 mm的圆柱样品和直径为10 mm厚度为1 mm的圆片样品。圆柱状样品用于测试抗压强度,圆片状样品用于测试压电和介电性能。
将压实的圆片样品放入常压烧结炉中烧结,升温速率为5℃/min,降温速率为10℃/min。将BT含量分别为10%、30%、70%和90%的样品在1200℃烧结1 h;将BT含量为70%的样品再分别在1000,1100和1300℃烧结1 h。将BT的含量分别为10%、30%、70%、90%的HA-BT复合材料样品,分别记为HA-10BT、HA-30BT、HA-70BT和HA-90BT。
1.2 性能表征
用阿基米德排水法测试陶瓷样品的密度,测试三个样品取其结果的平均值;使用D/max2200PCX光衍射仪测试样品的物相组成;使用S4800场发射扫描电镜及其附带的X射线能谱仪检测样品的微观形貌;使用STA449F3同步热分析仪对样品进行TG-DSC分析。使用1036PC万能材料试验机测试圆柱形样品的压缩强度;
为了测量复合材料的压电性,需要对样品进行极化处理。采用油浴极化法,以甲基硅油为绝缘介质,极化温度为80℃,极化时间为20 min。在电势3 kV下对材料加强直流电场进行极化处理,使电畴沿电场方向取向排列。使用LC2735准静态压电系数测量仪和ZJD-C型介电常数测试仪分别检测极化后样品的压电常数
2 结果和讨论
2.1 原料的配比对复合材料性能的影响
不同BT含量在1200℃烧结1 h的HA-BT复合材料,其XRD图谱如图1a所示。在1200℃烧结时HA与BT发生分解和反应,导致CaTiO3、Ca3(PO4)2、TiO2、BaTi2O5、Ba2TiO4以及Ba4Ti13O30的生成。当BT含量低于30%时,随着BT含量的提高生成的CaTiO3相强度呈提高的趋势,在HA-30BT中强度最高。在HA-30BT复合材料中还有BT的分解产物Ba2TiO4、Ba4Ti13O30。当BT的含量为70%时,HA的分解产物有Ca3(PO4)2相和少量的TiO2、BaTi2O5。
图1
图1
在1200℃烧结1 h且BT含量不同的HA-BT复合材料的XRD谱和HA-70BT的XRD谱中的双峰结构
Fig.1
XRD patterns of HA-BT composite material sintered at 1200℃ for 1 h (a) and double-peak structure in XRD patterns of HA-70BT (b) (●BaTiO3, ■Ca10(PO4)6(OH)2, ▲CaTiO3, ◆Ca3(PO4)2, △Ba4Ti13O30, ○Ba2TiO4, ◇TiO2, □BaTi2O5)
HA在1200℃分解并与BT发生反应,钙钛矿结构中的Ba2+被Ca2+取代生成了CaTiO3次生相,在HA-30BT中强度最高。Inoue M等[25]研究表明,CaTiO3能促进细胞分化,且其生物活性和生物相容性高。HA分解后,还生成了Ca3(PO4)2(磷酸三钙)相[21,26]。Ca3(PO4)2是一种常见的生物活性材料,也是研究最多的磷酸钙生物材料。它具有比HA更优异的降解性能,降解产生的Ca2+和PO43-释放到体内形成生物磷灰石沉淀在生物陶瓷表面,从而促进新骨生长[1]。Beril Ozcelik等[22]制备Ca3(PO4)2-BT复合材料并表征了其生物相容性,结果表明Ca3(PO4)2-BT复合材料较纯Ca3(PO4)2材料相比具有更好的生物相容性。因此,本文在烧结过程中产生一定量的CaTiO3相和Ca3(PO4)2相能提高复合材料的生物相容性和降解速率,预期其在骨修复应用上有积极作用。此外,BT的分解还生成了少量的TiO2、BaTi2O5、Ba2TiO4和Ba4Ti13O30相。Mina Tavangar [27]等研究表明,这些生成相无生物毒性且不影响材料的生物相容性。随着BT含量的提高,BT相的特征峰随之出现。HA-70BT复合材料在2θ=45°处出现双峰结构,如图1b所示。根据F. Vouilloz[28]等的结果,出现双峰结构的原因是BT的四方相结构。四方相BT自发极化显示出良好的铁电和压电性能,有利于HA-BT复合材料压电性能的产生。BT含量为90%时,因HA含量过低而不能发生明显的反应,主相为BT。HA-90BT复合材料在2θ=45°只出现一个衍射峰,说明复合材料有BT的立方相。
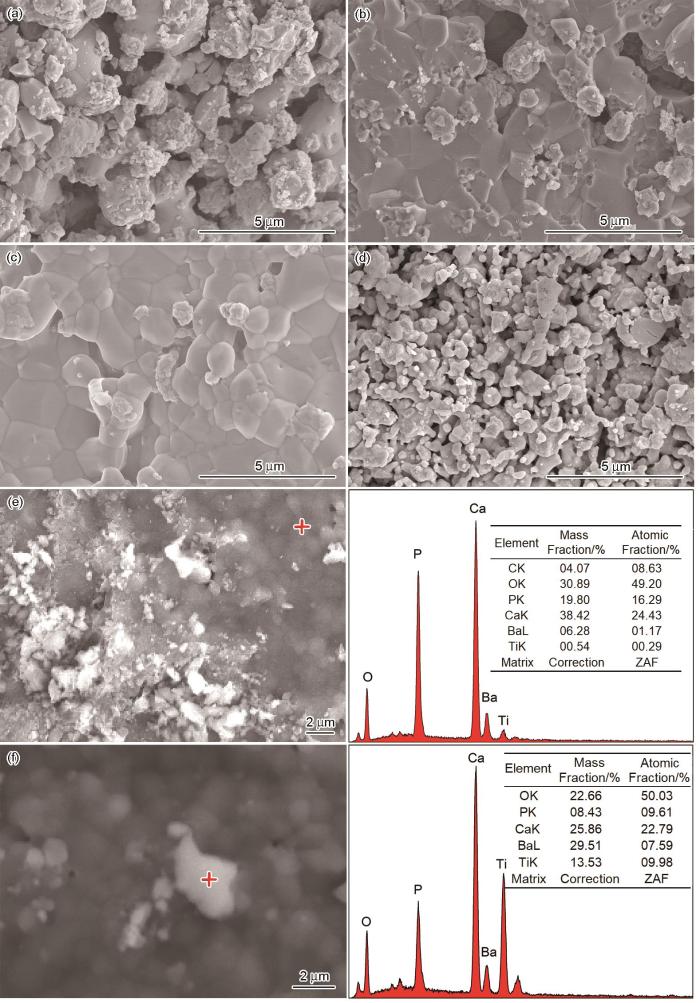
图2a~d给出了BT含量不同在1200℃烧结1 h的HA-BT复合材料的SEM照片。可以看出,HA-10BT的晶粒之间孔隙较大,尺寸分布不均,尺寸较小的晶粒团聚并附着在大晶粒表面。其原因是,纳米颗粒的超高表面能使小晶粒团聚成尺寸为1~3 μm的团聚体。随着BT含量的提高,尺寸均匀性随之提高。HA-30BT的晶粒生长稍为致密,孔隙率降低,但是产生了与HA、BT发生分解反应甚至有液相生成相关的微孔和大孔,仍有纳米级晶粒团聚附着在大晶粒表面。HA-70BT的微观结构较为致密,晶粒尺寸分布均匀,粒径为0.5~1.5 μm,粒径分布范围窄且有少许孔隙形成。其原因是,发生反应性烧结生成了次生相。孔隙明显比HA-30BT少,说明在烧结过程中反应性降低。BT含量为90%的HA-BT复合陶瓷材料,其晶粒分散,晶粒尺寸大幅度减小约为30~150 nm,且具有明显的颗粒形状,仍有纳米级颗粒团聚。与另外三种材料相比其晶粒间的孔隙率明显增大,可能是在此工艺条件下未发生生成新物质的反应烧结,晶粒表面张力较小使烧结驱动力低,晶粒没有足够的表面结合能使其接触。
图2
图2
不同BT含量在1200℃下烧结1 h的HA-BT的SEM照片和EDS图
Fig.2
SEM images (a~d) and EDS images (e, f) of HA-BT with different BT content sintered at 1200℃ for 1 h (a) HA-10BT; (b) HA-30BT; (c) HA-70BT; (d) HA-90BT; (e, f) EDS spectrum of HA-70 BT composite
用阿基米德排水法测得的各样品的密度,如图3a所示。可以看出,复合材料的密度随着BT含量的提高而提高,是由于BT的理论密度(6.017 g/cm2)大于HA的理论密度(3.156 g/cm2)。
图3
图3
不同BT含量在1200℃下烧结1 h的HA-BT复合陶瓷材料的密度和抗压强度
Fig.3
Density (a) and compressive strength (b) of HA-BT composite ceramic materials with different BT content after sintering at 1200℃ for 1 h
不同BT含量在1200℃烧结1 h的HA-BT复合陶瓷材料的抗压强度,如图3b所示。可以看出,本文制备的HA-BT复合陶瓷材料,其抗压强度均高于纯HA的抗压强度(24.2 MPa)[27]。随着BT含量的提高HA-BT复合材料的抗压强度随之提高,这可以归因于BT较高的密度。如图2所示,与HA-10BT、HA-30BT相比,HA-70BT的晶粒间致密性较高,并且BT含量的提高相应地降低了HA的分解,从而使其抗压强度提高。综合图2和图3给出的结果,随着BT含量的提高复合材料的孔隙率降低,密度增大使抗压强度提高。BT含量为70%的材料,其抗压强度值为182.88 MPa,与文献[29]中人体皮质骨的抗压强度(130~180 MPa)接近。但是,HA-90BT的抗压强度却有所下降,与其孔隙率较高有关。
BT含量不同的HA-BT复合陶瓷材料的压电常数(d33),如图4a所示。压电相(BT相)质量分数低于30%的材料,未显示出压电性。其原因是,BT质量分数低于30%的材料在1200℃烧结过程中,压电相BT在反应中被消耗了。另一个原因是,BT含量较低的材料其微观结构不致密,较多的孔隙结构阻碍了极化。这也是不同组分的材料,其介电常数一直存在而压电常数不明显的原因[21,27,28]。随着BT质量分数的提高,压电常数则随之提高。BT质量分数为70%的材料,其压电常数为2 pC/N,与人体骨的压电常数(0.7-2.3 pC/N)接近[29]。HA-90BT的压电常数值为3 pC/N,与BT含量较低的复合材料相比,压电相BT的增加使压电常数稍有所提高;而与纯BT的压电常数(37±16 pC/N)相比[28],非压电相HA的存在以及微观结构使其压电常数值的大幅度降低。
图4
图4
不同BT含量在1200℃烧结1 h的HA-BT复合陶瓷材料的电学参数
Fig.4
Electrical parameters of HA-BT composite ceramic materials with different BT content sintered at 1200℃ for 1 h (a) piezoelectric constant (d33); (b) dielectric constant (
图4b给出了不同组分的复合材料在频率为10 kHz时的介电常数(
2.2 烧结温度对复合材料性能的影响
图5给出了在不同温度烧结的HA-70BT的XRD谱。烧结温度为1000℃材料,烧结温度较低使BT与HA没有分解,除了主相BT只有少量的HA相。1100℃烧结,BT与HA分解并反应生成CaTiO3相、Ca3(PO4)2相以及少量的TiO2,BT与TiO2形成不稳定相BaTi2O5。在图5中CaTiO3相的峰强度在1200 ℃达到最高,Ca3(PO4)2相的峰强度在1100℃时达到最大值。烧结温度为1300℃时,生成的各相强度均有所降低。BT相的含量随着烧结温度的提高逐渐降低。这表明,在1100~1300°C的温度烧结的材料其相组成相同,但是随着烧结温度的提高各相的含量有所变化。因此,应该根据应用的要求 选择合适的烧结温度。
图5
图5
在不同温度烧结的HA-70BT的XRD谱
Fig.5
XRD patterns of HA-70BT sintered at different temperatures (●BaTiO3, ■Ca10(PO4)6(OH)2, ▲CaTiO3, ◆Ca3(PO4)2,□BaTi2O5,◇TiO2)
为了详细地了解HA-70BT复合材料在0~1250℃烧结发生的反应,对其进行热分析。样品的TG-DSC图,如图6所示。由TG曲线可以看出,在室温与1250℃之间质量损失为1.3%,比文献[26]中HA-20BT的热分析结果显著减少。这表明,质量损失与HA的含量相关。本文研究的复合材料其HA含量较低,因此质量损失较少。DSC曲线上0~140℃的质量损失对应一个缓慢的放热峰,可以推测是样品吸附水的蒸发所致。在640℃和800℃有两个缓慢的放热峰,但是质量损失不明显。此温度范围属于固相反应中BT四方相形成时的相变温区,即可能是BT四方相的形成所致。1000~1200℃的明显放热峰,可归因于HA脱羟基分解为Ca3(PO4)2和H2O,而H2O在高温下挥发。
图6
综合XRD、EDS以及TG-DSC谱,可推测HA-70BT样品在1200℃的反应机理为
根据以上结果,用图7给出的晶体结构图表示发生的总反应。
图7
钙钛矿结构的BT与六方结构的HA作为初始反应的反应物,其质量比为HA∶BT=3∶7。HA约在1100℃开始脱羟基分解为具有简单六方结构的Ca3(PO4)2,并分解出Ca2+和PO43-,其中Ca2+与由于BT分解产生的TiO32-反应生成了具有简单正交结构的CaTiO3。同时,少量BT分解产生的Ti4+与HA分解产生的OH-合成四方结构的TiO2,而TiO2与一部分BT以非稳定结构的BaTi2O5存在。值得注意的是,在此烧结条件下只有部分BT与HA发生反应,仍有BT以四方结构的形式稳定存在,以提供电学性能。其中生成物CaTiO3和Ca3(PO4)2可分解出Ca2+和PO43-,使复合材料的生物相容性和降解率提高以应用于人体。
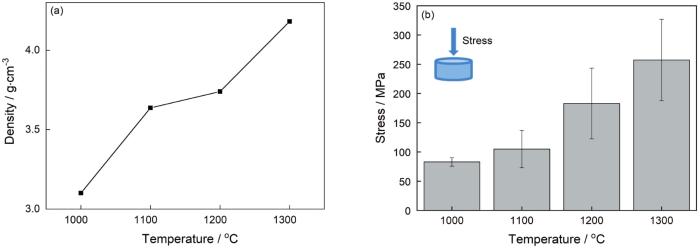
图8给出了不同温度烧结的HA-70BT的微观形貌。可以看出,随着烧结温度的提高孔隙率显著降低,致密度提高。在1000℃烧结的材料,小晶粒多且出现团聚,晶粒较分散其孔隙率大且尺寸不均匀。由图9a可见,在此条件下烧结的材料其密度较低。在1100℃烧结的材料,晶粒尺寸增大但是仍出现较多的孔隙。在1200℃烧结的材料,其结构较为致密且粒径的分布较窄。当烧结温度提高到1300℃时,反应烧结的驱动能变大,大部分晶粒的形核中心相互吞而长大,结果是大颗粒明显增多。此时气孔减少,致密度明显提高。但是,晶粒异常生长使尺寸不均匀,且出现台阶状纹路。随着烧结温度的提高晶粒显著生长且致密性提高,意味着温度对烧结动力学有显著的影响。这些结果,与图9a给出的HA-70BT的密度随着烧结温度的提高而提高的结果相符。
图8
图8
在不同温度烧结的HA-70BT的微观形貌
Fig.8
Micro-morphology of HA-70BT sintered at different temperatures (a) 1000℃; (b) 1100℃; (c) 1200℃; (d) 1300℃
图9
图9
在不同温度烧结的HA-70BT的密度和抗压强度
Fig.9
Density (a) and compressive strength (b) of HA-70BT sintered at different temperatures
烧结温度的提高使晶粒获得的原子振动能增大,这些能量使之形成晶界并促使晶界移动。随着晶界的移动晶粒逐渐长大,晶粒之间相互连通的孔隙随之逐渐变小直至消失。烧结温度越高则晶粒长大越快,气孔的排出越彻底,样品的收缩率也越大,从而使样品的密度和力学性能提高。但是,烧结温度并不是越高越好。从图8d可以看出,烧结温度过高使晶粒生长出现缺陷,如晶粒异常长大,形成两极化粒度分布。
在不同温度烧结的HA-70BT,其压电常数如图10a所示。可以看出,在1000~1300℃烧结的材料,其压电常数小幅度增大后基本上保持不变,表明烧结温度对压电常数的影响不大。
图10
图10
在不同温度烧结的HA-70BT的电学参数
Fig.10
Electrical parameters of HA-70BT sintered at different temperatures (a) Piezoelectric constant (d33); (b) Dielectric constant (
由图10b可见,HA-70BT的介电常数值随着烧结温度的提高而有所增大,其原因可能是在不同温度烧结的材料其晶粒大小、晶体内部微观结构不同。不同样品的介电损耗稍有不同,可归因于各样品的相组成不同。
上述结果表明,烧结温度是制备HA-BT复合陶瓷生物材料重要的控制因素之一,对HA-BT复合材料的微观结构、力学性能、电学性能有重要的影响。在1200℃烧结的HA-70BT,其显微结构致密性高,力学性能、电学参数与人体骨组织相仿,有望应用于骨修复领域。
3 结论
以BT和纳米HA为原料用常压烧结工艺可制备HA-BT生物压电复合陶瓷材料,其机械强度和电学性能与人体骨组织相仿。HA与BT在一定温度下烧结时发生分解反应产生CaTiO3、Ca3(PO4)2等次生相。在1200℃烧结、BT的质量分数为70%的复合材料,其显微结构致密,粒径分布窄,抗压强度和压电常数分别为110.215 MPa和2 pC/N。在不同温度烧结的复合材料其性能不同,可归结于不同的组分、微观形貌和密度以及烧结反应动力学。
参考文献
3D-printed bioceramic scaffolds: From bone tissue engineering to tumor therapy
[J].
Controlled and sustained delivery of siRNA/NPs from hydrogels expedites bone fracture healing
[J].
Stem cell-based bone regeneration in diseased microenvironments: Challenges and solutions
[J].
Bone regeneration with micro/nano hybrid-structured biphasic calcium phosphate bioceramics at segmental bone defect and the induced immunoregulation of MSCs
[J].
Porous composite scaffold incorporating osteogenic phytomolecule icariin for promoting skeletal regeneration in challenging osteonecrotic bone in rabbits
[J].
On the piezoelectric effect of bone
[J].
Enhanced bone ingrowth into hydroxyapatite with interconnected by electrical polarization
[J].
Human osteoblast-like cell adhesion on titanium substrates covalently functionalized with synthetic peptides
[J].
Mechanical deformation and electrical polarization in biological substances
[J].
Piezoelectric effects in collagen
[J].
Crystal structure of hydroxyapatite
[J].
Hydrothermal synthesis and properties characterization of barium titanate/hydroxyapatite spherical nanocomposite materials
[J]. J.
Functionally gradient and micro-channeled Al2O3-(t-ZrO2)/HAp composites
[J].
Effects of coatings on the mechanical properties of carbon fiber reinforced HAP composites
[J].
Polarization of hydroxyapatite: Influence on osteoblast cell proliferation
[J].
Role of surface charge and wettability on early stage mineralization and bone cell-materials interactions of polarized hydroxyapatite
[J].
A new approach to enhancement of bone formation by electrically polarized hydroxyapatite
[J].
Growth of calcium phosphate on poling treated ferroelectric BaTiO3 ceramics
[J].
Promotion of osteogenesis by a piezoelectric biological ceramic
[J].
Fabrication and in vitro biological properties of piezoelectric bioceramics for bone regeneration
[J].
Multifunctional properties of multistage spark plasma sintered HA-BaTiO3‐based piezobiocomposites for bone replacement applications
[J].
A study on calcium phosphate/barium titanate composites: phase characterization, piezoelectric property, and cytocompatibility
[J].
A new class of bio-composite materials of unique collagen fibers
[J]. J.
Dielectric properties of barium titanate ceramics with different materials powder size
[J].
Effect of a new titanium coating material (CaTiO3-aC) prepared by thermal decomposition method on osteoblastic cell response
[J].
Spark plasma sintering of hydroxyapatite powders
[J].
Manufacturing and characterization of mechanical, biological and dielectric properties of hydroxyapatite-barium titanate nanocomposite scaffolds
[J].
Reactivity of BaTiO3-Ca10(PO4)6(OH)2 phases in composite materials for biomedical applications
[J].
Biodegradable and bioactive porous polymer/inorganic composite scaffolds for bone tissue engineering
[J].
An Introduction
[M].