1 实验方法
1.1 实验用材料
实验用材料:4-PEG-OH(5000 Da),5-降冰片烯-2-羧酸(NB),二环己基碳二亚胺(DCC),吡啶,4-二甲氨基吡啶(DMAP),二氯甲烷(DCM),乙醚,二硫苏糖醇(DTT),苯基-2,4,6-三甲基苯甲酰基亚磷酸锂(LAP),磷酸盐缓冲溶液(PBS),去离子水(DI water),人脐静脉内皮细胞(HUVECs),内皮细胞培养基(Medium),胎牛血清(FBS),内皮细胞生长因子(ECGS),REDV多肽,CCK-8试剂盒。
1.2 4-PEG-NB的合成
根据文献[16]中的方法合成4-PEG-NB。将与4-PEG-OH的 5 mol/L相比过量的NB和与2 mol/L相比过量的DCC在装有DCM的圆底烧瓶中反应1 h,生成酸酐后缓慢转移至干燥的容器中过夜。然后将其溶解在40 mL DCM的PEG溶液中,随后在其中加入0.5 mol/L过量的DMAP和5 mol/L过量的吡啶。整个过程在氩气保护下进行。反应过夜后将产物过滤和旋蒸并在冰乙醚中沉淀,最后在DI water中透析2~3 d。将产物冷冻干燥后,用1H NMR(溶剂为DMSO)验证。
1.3 4-PEG-NB水凝胶的制备
使用质量分数为5%的PEG-NB作为水凝胶聚合单体,改变交联剂DTT与单体之间的比例为硫醇:烯=0.5、0.75、1制备软(Soft)、中(Med)和硬(Stiff)三种硬度的水凝胶。在EP管或其它模具中依次加入4-PEG-NB和对应比例的DTT、LAP、DI water,用紫外灯照射10 min使水凝胶前体溶液交联成凝固胶状物。
1.4 4-PEG-NB水凝胶的性能表征
使用扫描电子显微镜(JSM 7800F, SEM)观察水凝胶的微观形貌。将三种硫醇-烯比例的水凝胶冷冻干燥24 h,然后用手术刀片切片并用导电胶将样品固定,喷金后上机观察。同时,用乙醇置换法[17]计算水凝胶的孔隙率(PR)。将冷冻干燥后的水凝胶在无水乙醇中溶胀至饱和,称量水凝胶的冻干后和溶胀后的质量,其孔隙率为
其中W1和W2分别为水凝胶冻干后和溶胀后的质量,
用傅里叶变换红外光谱仪(Nicolet 5700, FTIR)检测水凝胶的化学结构。将三种硫醇-烯比例的水凝胶样品冷冻干燥24 h后,将其与KBr粉末在玛瑙中研磨,用压片机制片后测试其红外光谱。同时,用索氏提取法测定水凝胶的凝胶分数(GF)以表征其交联度[18]。将三种硫醇-烯比例的水凝胶称质量后放入索氏套管中,在甲醇溶剂中回流24 h后在60℃下干燥,然后测试剩余样品的质量。凝胶分数为
式中W3为水凝胶的初始质量,W4为水凝胶剩余质量。
用动态剪切流变仪(DHR-1)进行水凝胶的流变学实验,计算其杨氏模量。将三种硫醇-烯比例的水凝胶在特定圆形模具中成胶后加入PBS使其溶胀,自然脱模后取出水凝胶放入流变仪的检测平台上,在线性粘弹性区域(1%应变,角频率0~100 rad/s)中测量以确定剪切储能模量G'和损耗模量G''。然后将剪切储能模量转换为杨氏模量E,即
其中G'为剪切储能模量,
测试软、中、硬三种硬度水凝胶样品的干重Wd,将其在室温下分别浸泡在含10% FBS的培养基、PBS和DI water中,每隔一定时间取出水凝胶样品,去除多余的表面水分后记录其湿重Wt,直至不再变化或变化极小,则其溶胀率(SR)为
式中Wd为水凝胶溶胀前的干重,Wt为水凝胶溶胀后的湿重。
随后继续将水凝胶样品浸泡在各溶液中,每天记录样品的质量,每7 d更换一次溶液。用
其中W5为第一天记录的水凝胶质量,W6为随后每天记录的水凝胶质量。
质量保留量表征水凝胶的降解性能。同时,观察降解最快时水凝胶样品的SEM微观形貌。
1.5 4-PEG-NB水凝胶药物释放的表征
采用甲硝唑为模型测定药物的释放。将水凝胶样品浸泡在10 mL浓度为20 μg/mL的甲硝唑溶液中,完全溶胀后用差减法[20]计算水凝胶的药物包封率(EE)。药物包封率为
式中M1为水凝胶的含药量,M2为投药量。
然后将其转移至30 mL的PBS溶液中,在25℃置于恒温振荡器(ZWY-240)中以120 r/m的频率振荡,每隔一定时间取出3 mL的PBS,使用紫外分光光度计(TU-1901)测定其吸光度(波长为319.5 nm),然后补入3 mL新鲜PBS。根据标准曲线确定甲硝唑释放量,绘制甲硝唑的累积释放曲线。
1.6 4-PEG-NB水凝胶的生物相容性表征
从新生儿脐带中分离出HUVECs,使其在含有10% FBS和1% ECGS的内皮细胞培养基中进行常规繁殖。实验用HUVECs为第6至第8次传代,所有细胞均在37℃、5% CO2条件下培养。
对于2D模型水凝胶,在48孔板中依次加入4-PEG-NB、DTT、LAP、DI water配成100 μL前体液,紫外照射10 min使其成胶,然后加入50 μL REDV(1 mM/L)与LAP的混合溶液,再次用紫外照射10 min后向每孔加入300 μL含有5×103个细胞的培养基,每2 d更换一次培养基,每次300 μL。
对于3D包封水凝胶,在48孔板中依次加入4-PEG-NB、DTT、LAP、REDV配成150 μL前体液,再加入100 μL含有5×103个细胞的培养基,充分混匀后用紫外照射10 min使其成胶,最后加入200 μL含有10% FBS的培养基进行培养,每2 d更换一次培养基,每次300 μL。
使用CCK-8试剂评估水凝胶的生物相容性。将HUVECs在2D、3D水凝胶上分别培养1 d、3 d、5 d,除去上清液后加入300 μL含有10% CCK-8的培养基,孵育3 h后从每孔吸取100 μL至96孔板中,读取酶标仪(Synergy H1)450 nm处的吸光度,并通过空白对照组归一化结果确定细胞活力。CCK-8的空白对照组,是在48孔板中加入含有5×103个细胞的450 μL培养基。
1.7 统计学分析
对每个实验,设置n≥3平行样本进行统计分析。使用Origin或GraphPad Prism软件对实验数据进行统计处理,以平均值±标准差表示处理结果。
2 实验结果
2.1 4-PEG-NB的1H NMR谱
图1
图2
图2
4-PEG-NB水凝胶的制备流程和制备出的水凝胶照片
Fig.2
Preparation process of 4-PEG-NB hydrogel (a) and hydrogel prepared (b)
2.2 水凝胶的性能
图3给出了三种硫醇-烯比例水凝胶的SEM照片。可观察到,在5% PEG-NB单体浓度下制备的三种硫醇-烯比例的水凝胶,都具有孔隙结构但是其孔隙结构的状态不同。随着硫醇-烯比例的提高水凝胶的交联更加密集,孔隙数量逐渐增多而孔径的尺寸逐渐减小。
图3
图3
硫醇-烯比例为0.5、0.75和1的水凝胶的截面SEM照片
Fig.3
Cross-sectional SEM images of hydrogels with thiol-ene ratio 0.5 (a), 0.75 (b) and 1 (c)
用乙醇置换法测定三种交联比例的水凝胶孔隙率,结果如图4所示。可以看出,5% PEG-NB单体浓度使该水凝胶的孔隙率较低,而随着硫醇-烯比例的提高孔隙率随之提高。
图4
图4
三种不同硫醇-烯比例水凝胶的孔隙率
Fig.4
Porosity of three hydrogels with different thiol-ene ratio
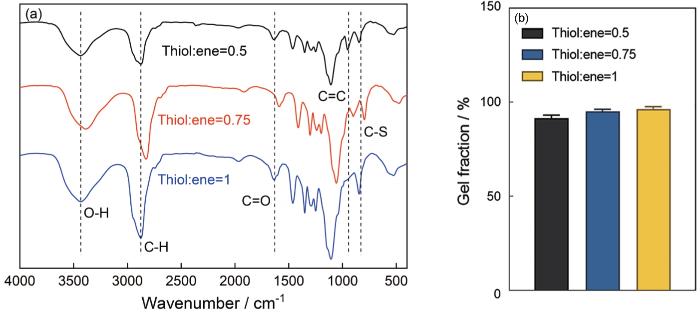
图5a给出了三种硫醇-烯比例水凝胶的FTIR谱。在FTIR谱中标识的954、1630、2880 cm-1处的峰分别归属于4-PEG-NB的烯烃C=C、酯C=O和C-H振动峰,3434 cm-1处的宽峰归属于DTT的O-H振动峰,847 cm-1处归属于硫醇-烯点击反应生成的C-S振动峰。随着硫醇-烯比例的提高C-S振动峰的强度随之提高,而烯烃C=C振动峰的强度降低直至消失。在全谱中未出现DTT的S-H振动峰(2540 cm-1左右),表明DTT反应完全、硫醇-烯的反应程度较高。用索氏提取法测定的交联度,如图5b所示。可以看出,三种硫醇-烯比例水凝胶的交联度(凝胶含量)分别为91%、95%、96%,交联程度较高且与FTIR谱对应,表明硫醇-烯反应的高效进行。交联度的计算结果表明,0.5、0.75、1三种理论交联比例的水凝胶其实际交联摩尔比例分别为0.46、0.713、0.96。
图5
图5
三种不同硫醇-烯比例水凝胶的FTIR谱和交联度
Fig.5
FTIR spectra (a) and cross-linkage (b) of three thiol-ene ratio hydrogels
图6
图6
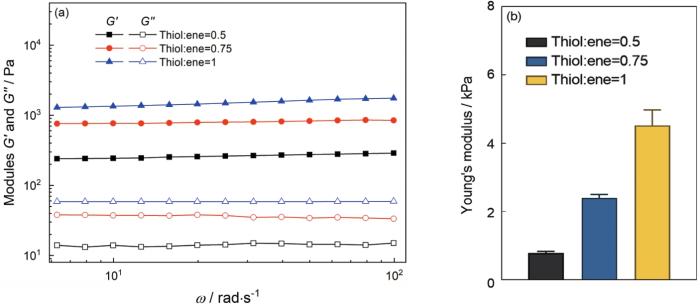
不同硬度水凝胶的储能模量(G')、损失模量(G'')和转换后的杨氏模量
Fig.6
Storage modulus (G') and loss modulus (G'') of hydrogels with different stiffness (a) and conversion to Young's modulus (b)
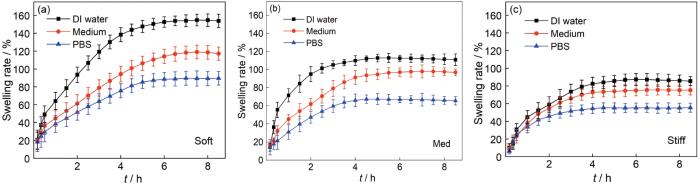
三种硬度水凝胶在DI water、Medium和PBS中的溶胀曲线,如图7所示。可以看出,三种水凝胶的溶胀趋势相同,即在DI water中溶胀率最大,在Medium中的其次,在PBS中最小;随着水凝胶交联比例和硬度的提高,溶胀率反而降低。
图7
图7
软、中、硬3种水凝胶在去离子水、含血清培养基和磷酸盐缓冲溶液中的溶胀动力学曲线
Fig.7
Swelling kinetic curves of soft (a), med (b), stiff (c) hydrogels in DI water, medium and PBS
图8给出了三种硬度水凝胶在充分溶胀后连续35 d内的降解。用质量保留率表征其降解性能。在持续测定中发现,水凝胶在体外具有一定的降解能力,其中软胶的降解较快,随着水凝胶硬度的增大水凝胶的降解速率降低。
图8
图8
软、中、硬3种水凝胶在去离子水、含血清培养基和磷酸盐缓冲溶液中的降解曲线
Fig.8
Degradation curves of soft (a), med (b), stiff (c) hydrogels in DI water, medium and PBS
这种水凝胶在DI water中的降解程度最高,因此选用水凝胶在该溶剂中降解进行SEM观察。三种硬度水凝胶在DI water中降解7 d的SEM照片,如图9所示。可以看出,与初始形态相比,依然能观察到三种硬度水凝胶的孔隙结构。但是降解使水凝胶的孔隙结构出现明显的破损(图中黑色箭头指示了部分破损处),在孔隙之间出现桥接,网络结构不再完整。随着水凝胶硬度的提高孔隙结构的破损减少,表明降解速度降低。
图9
图9
软、中、硬3种水凝胶在去离子水中降解7 d的SEM照片
Fig.9
SEM images of soft (a), med (b), stiff (c) hydrogels degradation in DI water for 7 d
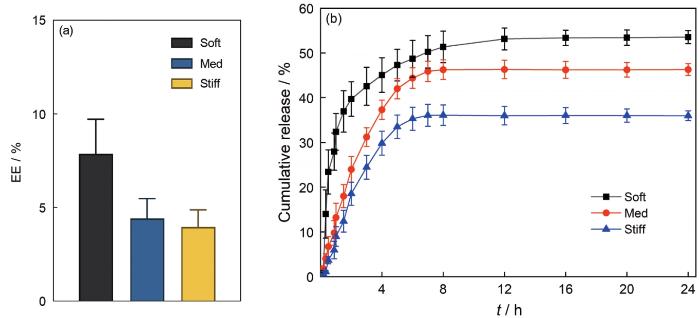
2.3 水凝胶的药物释放
图10
图10
不同硬度水凝胶负载甲硝唑药物的包封率和累计释放曲线
Fig.10
Encapsulation efficiency (a) and cumulative release curves (b) of different stiffness hydrogels loaded with metronidazole
2.4 水凝胶的生物相容性
将软、中、硬三种水凝胶分别用于2D、3D细胞培养,用CCK-8试剂测定细胞活性。与空白对照组归一化后的结果,分别如图11a、b所示。可以看出,这种水凝胶在杨氏模量小于5 kPa范围内,HUVECs在1、3、5 d的2D和3D体外培养中都保持较好的细胞活性,细胞有较高的增殖能力。与2D模型相比,3D包封的整体细胞活性略低。由此可了解到,在同种凝胶和相同杨氏模量的环境中,2D、3D不同培养模式培养的细胞活性不同;同时,在同一维度的细胞培养条件下,当杨氏模量小于5 kPa时,随着ECM硬度的提高细胞活性明显提高。这种差异,3D培养尤为突出。
图11
图11
不同硬度的水凝胶的在5 d内的2D、3D细胞培养活性
Fig.11
2D (a) and 3D (b) cell viability of hydrogels with different stiffness in 5 d
3 讨论
4-PEG-NB的合成,是水凝胶成胶的必要条件。本文使用DCC/DMAP酯化法制备4-PEG-NB,此法操作简单且合成效率高。由于所制备的高分子材料高度亲水且有很强的吸水能力,冻干后的4-PEG-NB也能迅速溶解在DMSO溶剂中,但依旧检测到了少量水分。使用软件分析后确认,4-PEG-NB合成率高达90%。
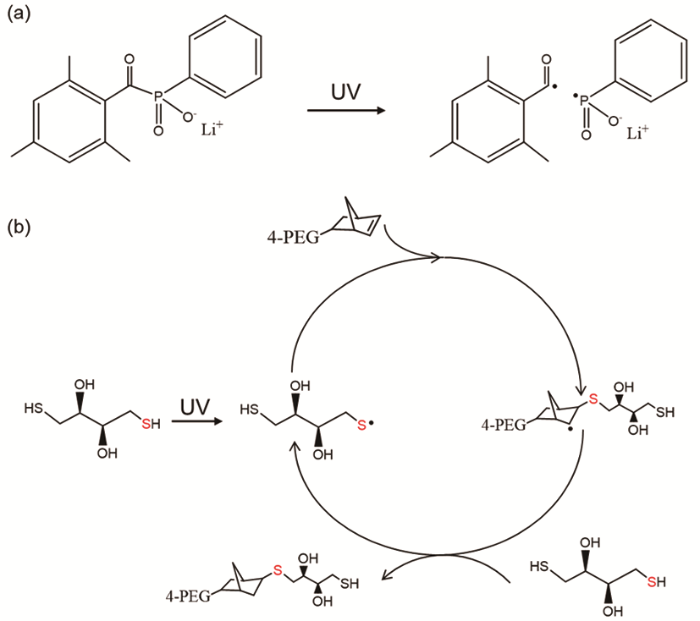
本文使用硫醇-烯点击化学原理制备硬度可调控的水凝胶,其机理如图12所示。紫外灯照射使光引发剂LAP发生裂解产生自由基(图12a),随后该自由基从DTT的巯基中提取质子生成巯基自由基,巯基自由基在降冰片烯的碳-碳双键中传播生成烷基自由基;该烷基自由基再从硫醇中抽出氢原子生成硫醚键并再生成巯基自由基,进入图12b所示的循环。依据硫醇-烯的化学计量比进行循环反应,直到硫醇或降冰片烯耗尽。FTIR谱验证了上述理论分析。理想的逐步增长机理是自由基传播和链转移反应交替逐步进行的,并且没有任何烯烃均聚反应。因此,与无规则链式生长相比,逐步生长式反应具有结构异质性低、网络结构相对规则均一和反应高效等特点。更重要的是,整个交联过程不受氧的抑制[21],使操作更加简便易行。
图12
图12
光引发剂通过光裂解生成自由基和4-PEG-NB与DTT之间自由基介导逐步式生长的硫醇-烯光点击反应示意图
Fig.12
Schematic diagram of thiol-ene click chemistry mechanism (a) photocleavage of photoinitiator LAP into radicals and (b) schematics of a radical-mediated step-growth thiol-ene photoclick reaction between 4-PEG-NB and DTT
作为大分子单体,4-PEG-NB的用量对于水凝胶的性能起决定性作用,而交联剂DTT的用量对水凝胶的结构特性有较大的影响。该实验体系使用了5%的四臂聚合物单体,采用硫醇:烯比值为0.5、0.75、1的交联比例制备水凝胶,理想化地分别代表两条臂、三条臂和四条臂参与反应,通过交联连接形成网络结构。交联度结果表明,硫醇-烯的反应是高效的。流变学实验结果表明,三种水凝胶各自的储能模量都远大于其对应的损耗模量,满足成胶的凝胶动力学条件。随着硫醇-烯交联比例的提高机械性能随之提高。因此,只需改变硫醇-烯的化学计量比例即可精确地调控水凝胶的硬度。对于更高硬度的基底硬度材料模拟,可通过提高4-PEG-NB的含量来实现。
水凝胶的孔隙率、溶胀率、降解性能和药物释放等材料性能,是水凝胶的固有属性,决定于高亲水性,而交联剂的交联比例对这些性能有极大的影响。水凝胶交联比例越高则孔隙率越高,但是该体系5%的4-PEGNB含量决定了凝胶孔隙率较低,SEM照片验证了这一点。但是,孔径结构的增多并不会使溶胀率提高,因为孔隙结构的增多使硬度提高、内部更加紧密、结实,能容纳的水分减少。水凝胶体外的降解实验表明,这种水凝胶具有降解性。随着水凝胶硬度的提高,其降解速度降低。这种硫醇-烯水凝胶的降解,是4-PEG-NB中的酯键在体外水解所致,降解速度受单体含量和溶剂环境影响。
本文制备的三种硬度的硫醇-烯水凝胶,分别模拟了脑、内皮、脂质组织的ECM硬度。用CCK-8试剂测定2D、3D细胞培养的相对活性,表明这种水凝胶在5 kPa硬度以内具有优异的细胞相容性。使用黏附多肽REDV用作生物修饰,能特异性地将内皮细胞整合在水凝胶表面或内部,使内皮细胞更好地贴壁生长。观察到3D模型中的细胞活性比2D模型略低,可能是3D模型的水凝胶将细胞包裹,内部细胞获得营养和氧气的机会较少所致;但是3D模型的细胞一直处于增殖状态,表现出材料良好的生物相容性。内皮细胞具有高度机械敏感性,能感知ECM硬度并做出响应。在该体系内,硬度的提高使细胞活性提高。尤其是3D环境更能体现机械微环境,其活性表现出更大差异,对内皮细胞有更大的调控作用,进一步证明了ECM的重要性。当然,对于较高硬度的ECM模拟,提高4-PEG-NB的单体含量即可得到相应的硬度,用于对应硬度组织的2D、3D ECM模拟。
4 结论
以4-PEG-OH与NB形成的4-PEG-NB聚合物为大分子单体,采用硫醇烯点击化学方法和DTT高效交联可制备新型逐步式生长的具有降解性的水凝胶;改变硫醇-烯的比例可调节硬度,制备出不同硬度的基底并通过多维角度模拟ECM。掺入REDV多肽可提高材料的生物相容性,这种硫醇-烯水凝胶平台可用于2D和3D细胞体外培养。
参考文献
Biocompatibility of hydrogel-based scaffolds for tissue engineering applications
[J].
A self-assembled RNA-triple helix hydrogel drug delivery system targeting triple-negative breast cancer
[J].
Research status of self-healing hydrogel for wound management: A review
[J].
Extracellular matrix scaffold and hydrogel derived from decellularized and delipidized human pancreas
[J].
Extracellular matrix hydrogel derived from decellularized tissues enables endodermal organoid culture
[J].
Synthetic ECM: Bioactive synthetic hydrogels for 3D tissue engineering
[J].
Nano-mechanical mapping of interdependent cell and ECM mechanics by AFM force spectroscopy
[J].
Matrix elasticity, cytoskeletal forces and physics of the nucleus: how deeply do cells 'feel' outside and in?
[J].
Modeling physiological events in 2D vs. 3D cell culture
[J].
ECM in differentiation: A review of matrix structure, composition and mechanical properties
[J].
A review of gradient stiffness hydrogels used in tissue engineering and regenerative medicine
[J].
Weak bond-based injectable and stimuli responsive hydrogels for biomedical applications
[J].
Nanoscale physicochemical properties of chain- and step-growth polymerized PEG hydrogels affect cell-material interactions
[J].
Click chemistry and material selection for in situ fabrication of hydrogels in tissue engineering applications
[J].
Improving functional re-endothelialization of acellular liver scaffold using REDV cell-binding domain
[J].
Sequential thiol–ene and tetrazine click reactions for the polymerization and functionalization of hydrogel microparticles
[J].
Silver nanoparticle impregnated chitosan-PEG hydrogel enhances wound healing in diabetes induced rabbits
[J].
Structure-property of crosslinked chitosan/silica composite films modified by genipin and glutaraldehyde under alkaline conditions
[J].
High-throughput screening of vascular endothelium-destructive or protective microenvironments: Cooperative actions of extracellular matrix composition, stiffness, and structure
[J].
Chitosan cross-linked poly(acrylic acid) hydrogels: Drug release control and mechanism
[J].
Improving gelation efficiency and cytocompatibility of visible light polymerized thiol-norbornene hydrogels via addition of soluble tyrosine
[J].